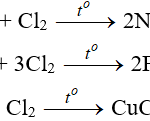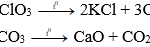Tính chất hóa học của kim loại và các dạng bài tập liên quan chuẩn 100%
Lý thuyết về kim loại đóng vai trò quan trọng trong chương trình Hóa học vô cơ. Do đó, muốn làm chủ được các dạng bài tập ở phần này, các em cần phải nắm rõ các kiến thức liên quan đến kim loại. Các em hãy đọc ngay bài viết bên dưới đây của chúng tôi để tìm hiểu về khái niệm kim loại là gì, tính chất vật lý cũng như các tính chất hóa học của kim loại.
Tham khảo thêm:
- Độ tan là gì? Công thức tính độ tan và các dạng bài tập có lời giải chi tiết nhất
- Cách xác định hóa trị của 1 nguyên tố và các dạng bài tập
- Ankin là gì? Tích chất, công thức tổng quát, cách điều chế ankin và bài tập ứng dụng
Nội Dung
Kim loại là gì?
Kim loại là những nguyên tố hóa học mà trong đó tồn tại những ion dương (hay còn được gọi là cation) và những liên kết kim loại.
Cấu tạo của kim loại
Cấu tạo nguyên tử:
- Hầu hết, những nguyên tử kim loại đều có rất ít electron tồn tại ở lớp ngoài cùng (khoảng từ 1, 2 hoặc 3 e).
- Trong một chu kì, nguyên tử của các nguyên tố kim loại có điện tích hạt nhân bé hơn so với các nguyên tử phi kim khác.
Cấu tạo tinh thể:
- Ở nhiệt độ thường, các kim loại tồn tại ở dạng rắn, trừ Hg (thủy ngân) ở dạng lỏng.
- Kim loại có 3 loại mạng tinh thể: lập phương tâm diện (Cu, Ag, Al,…), lập phương tâm khối (Li, Na, K,…) và lục phương (Mg, Be, Zn,…).
Phân loại kim loại
Các nguyên tố kim loại sẽ được phân thành những nhóm cơ bản như sau:
- Kim loại hiếm và kim loại cơ bản: Kim loại hiếm là những kim loại ít gặp, ít bị ăn mòn như vàng hoặc bạch kim. Còn cụm từ “cơ bản” là để chỉ các kim loại dễ bị oxi hóa và ăn mòn.
- Kim loại đen và kim loại màu: Những kim loại có màu đen như crom, sắt, titan,… được gọi là các kim loại đen. Kim loại màu chỉ những kim loại có ánh kim và màu sắc như vàng, bạc, kẽm, đồng,…
- Kim loại nặng và kim loại nhẹ:Những kim loại nhẹ sẽ có khối lượng riêng nhỏ hơn 5g/cm3 (Na, K, Mg,…). Ngược lại, các kim loại nặng sẽ có khối lượng riêng lớn hơn 5g/cm3 (Fe, Zn, Pb,…).
Tính chất hóa học của kim loại
Tác dụng với phi kim
+) Tác dụng với oxi (trừ Ag, Au, Pt)
![]()
Trên thực tế, đa số kim loại đều có khả năng cho phản ứng với oxi ở nhiệt độ thường hoặc ở điều kiện nhiệt độ cao để tạo ra các oxit (trừ Au, Pt, Ag,…).
+) Tác dụng với halogen:
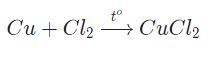
Một số kim loại cũng có thể tác dụng với halogen ở điều kiện nhiệt độ cao để tạo thành muối halogen.
+)Tác dụng với lưu huỳnh:
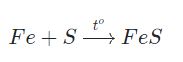
Kim loại còn có khả năng kết hợp với lưu huỳnh trong điều kiện nhiệt độ cao để tạo thành các sản phẩm muối sunfua.
+) Tác dụng với nitơ:
![]()
Một vài kim loại cho phản ứng với nitơ ở điều kiện thông thường.
Tác dụng với nước
+)Kim loại kiềm (Li, Na, K, Rb, Cs) và kiềm thổ (Ca, Sr, Ba):
2Na+2H2O→2NaOH+H2
Những kim loại mạnh như Li, Na, Ca,… có thể tác dụng với nước ở điều kiện nhiệt độ phòng để tạo ra các dung dịch bazơ và giải phóng khí H2.
+) Các kim loại khác Mg, Zn, Fe,…
Mg+2H2O → Mg(OH)2+H2
Các kim loại trung bình như Mg, Fe,… cần điều kiện nhiệt độ cao mới có thể phản ứng với nước để tạo thành oxit kim loại (trừ Mg tan chậm trong nước nóng tạo thành dung dịch Mg(OH)2) và khí hiđro.
Tác dụng với dung dịch axit
Trong phần tính chất hóa học của kim loại, các em cũng cần để ý đến khả năng kết hợp với dung dịch axit của nhiều kim loại ở những điều kiện khác nhau.
Kim loại có thể cho phản ứng với một số axit mạnh (HCl, H2SO4 loãng,…) ở điều kiện thông thường để tạo thành muối và khí hiđro.
Mg+H2SO4(loãng)→MgSO4+H2
Khi cho kim loại tác dụng với HCl, HNO3 hay H2SO4 đặc nóng, các em sẽ thu được nhiều sản phẩm khử khác nhau.
+) Đối với HNO3 đặc nóng, khi tác dụng với kim loại sẽ thu được muối nitrat và nhiều loại khí như NO, NO2, N2O, N2 và muối NH4NO3.
+) Trường hợp cho kim loại phản ứng với H2SO4 đặc nóng, ta sẽ thu được muối sunfat cùng những loại khí như H2S, SO2 và S
Chú ý: Al, Fe và Cr trở nên thụ động trong HNO3 và H2SO4 đặc nguội.
Tác dụng với dung dịch muối
Tính chất hóa học đặc trưng của kim loạicuối cùng mà các em cần ghi nhớ đó là tác dụng với dung dịch muối. Phản ứng này còn được gọi với cái tên khác là phản ứng thủy luyện.
- Trong trường hợp kim loại kiềm và kiềm thổ như Na, Ca, Ba,…thì kim loại sẽ tác dụng với nước để tạo thành dung dịch kiềm và khí H2. Sau đó, dung dịch kiềm mới tạo thành quay ra tác dụng với muối. Phản ứng này chỉ xảy ra nếu kết quả thu được kết tủa, chất bay hơi hoặc chất điện li yếu.
- Đối với những kim loại khác khi tác dụng với muối sẽ tuân theo quy tắc alpha (α). Kim loại đứng trước trong dãy hoạt động của kim loại sẽ đẩy kim loại đứng sau ra khỏi dung dịch để tạo thành muối mới và kim loại mới.
Tính chất vật lý của kim loại
Tính dẻo
– Kim loại có tính dẻo.
– Các kim loại khác nhau có tính dẻo khác nhau.Do có tính dẻo nên kim loại được rèn, kéo sợi, dát mỏng tạo nên các đồ vật khác nhau.
• Tính dẫn điện
– Kim loại có tính dẫn điện.
– Các kim loại khác nhau có khả năng dẫn điện khác nhau. Kim loại có khả năng dẫn điện tốt nhất là Ag, sau đó đến Cu, Al, Fe,…Do có tính dẫn điện, một số kim loại được sử dụng làm dây dẫn điện. Thí dụ như: đồng, nhôm, …
– Chú ý: Không nên sử dụng dây dẫn điện trần hoặc dây điện đã bị hỏng lớp bọc cách điện để tránh bị điện giật, hay cháy do chập điện,…
• Tính dẫn nhiệt
– Kim loại có tính dẫn nhiệt .
– Kim loại khác nhau có tính dẫn nhiệt khác nhau. Kim loại nào dẫn điện tốt cũng thường dẫn nhiệt tốt.
– Dó có tính dẫn nhiệt và một số tính chất khác, nhôm, thép không gỉ (inox) được dùng để làm dụng cụ nấu ăn.
Ánh kim
– Kim loại có ánh kim.Nhờ tính chất này, một số kim loại được dùng làm đồ trang sức và các vật dụng trang trí khác.
Các dạng bài tập áp dụng tính chất hóa học của phi kim thường gặp
Bài 1: Đơn chất tác dụng với dung dịch H2SO4 loãng giải phóng khí hiđro là:
Giải:
Zn + H2SO4 (loãng) → ZnSO4 + H2
Bài 2: Dung dịch ZnCl2 có lẫn CuCl2. Kim loại nào sau đây dùng làm sạch dung dịch ZnCl2: Ba, Cu, Mg, Zn.
Giải:
Dung dịch ZnCl2 có lẫn CuCl2. Kim loại dùng làm sạch dung dịch ZnCl2 là: Zn.
Do có phản ứng Zn + CuCl2 → ZnCl2 + Cu
Lọc kết tủa ta thu được dd ZnCl2 tinh khiết
Bài 3: Dung dịch FeCl2 có lẫn tạp chất là CuCl2 có thể dùng kim loại nào sau đây để làm sạch dung dịch FeCl2 trên:
Giải
Sử dụng một lượng dư kim loại Fe
Fe + CuCl2 → FeCl2 + Cu↓
Lọc bỏ kết tủa thu được dung dịch FeCl2 tinh khiết.
Bài 4: Lấy một ít bột Fe cho vào dung dịch HCl vừa đủ rồi nhỏ từ từ dung dịch NaOH đến dư vào dung dịch. Hiện tượng xảy ra là:
Giải:
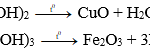
Fe + 2HCl → FeCl2 + H2↑
FeCl2 + 2NaOH → Fe(OH)2 (↓ trắng xanh) + 2NaCl
4Fe(OH)2 (↓) + O2 + 2H2O → 4Fe(OH)3 (↓ nâu đỏ)
Bài 5: Nung 6,4g Cu ngoài không khí thu được 6,4g CuO. Hiệu suất phản ứng là:
Giải:
nCu = 6,4 : 64 = 0,1 mol

Bài 6: Hoà tan hết 12g một kim loại ( hoá trị II) bằng dung dịch H2SO4 loãng thu được 6,72 lít khí H2 (đktc). Kim loại này là:
Giải:
Gọi kim loại là M, tính được nkhí = 6,72 : 22,4 = 0,3 mol
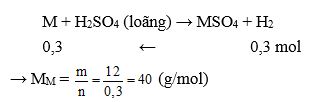
Vậy kim loại cần tìm là Ca.
Bài 7: Cho vào dung dịch HCl một cây đinh sắt , sau một thời gian thu được 11,2 lít khí hiđro (đktc). Khối lượng sắt đã phản ứng là:
Giải:
nkhí = 11,2 : 22,4 = 0,5 mol
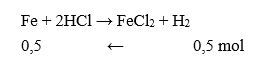
→ mFe = 0,5.56 = 28 gam.
Mong rằng những nội dung trên đây sẽ giúp bạn trả lời được những thắc mắc câu hỏi của mình. Hơn hết đó là có thể giải được những bài toán của mình