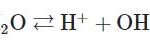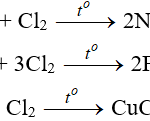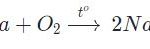Tính chất hóa học của bazo và các dạng bài tập liên quan chuẩn 100%
Bazơ là một hợp chất thường gặp trong chương trình hóa trung học cơ sở và trung học phổ thông. Việc hiểu rõ những kiến thức như bazơ là gì, công thức hóa học của bazơ cũng như tính chất hóa học của bazơ sẽ giúp các em xử lý tốt các dạng bài tập liên quan và học tốt môn học này. Các em hãy cùng chúng tôi tìm hiểu những nội dung này trong bài viết sau nhé.
Tham khảo thêm:
- Tính chất hóa học của axit và các dạng bài tập liên quan chuẩn 100%
- Ankin là gì? Tích chất, công thức tổng quát, cách điều chế ankin và bài tập ứng dụng
- Ankan là gì? Công thức tổng quát, tính chất và cách điều chế ankan kèm theo bài tập
Nội Dung
Bazo là gì?
Bazơ là hợp chất hóa học mà trong đó phân tử gồm có một nguyên tử kim loại liên kết với một hay nhiều nhóm OH (Hydroxit). Ngoài ra, ta cũng có thể hình dung bazơ chính là chất mà khi ta hòa tan trong nước sẽ tạo thành dung dịch có pH lớn hơn 7.
Bazơ có công thức chung dạng : B(OH)n.
Trong đó:
- B là một kim loại
- n là hóa trị kim loại.
Cách đọc tên bazơ:
Tên bazơ = Tên kim loại + (Hóa trị nếu kim loại có nhiều hóa trị) + Hidroxit
Ví dụ:
Al(OH)3 : nhôm hidroxit
Phân loại bazo
Dựa vào tính chất hóa học, có thể chia bazo thành:
- Bazo mạnh như: KOH, NaOH,…
- Bazo yếu như: Al(OH)3, Fe(OH)3,…
Dựa vào tính tan của bazo trong nước, bazo được chia thành 2 loại:
- Bazo tan trong nước tạo kiềm, như: NaOH, KOH, LiOH, RbOH, Ba(OH)2, Ca(OH)2, CsOH, Sr(OH)2.
- Bazo không tan: Mg(OH)2, Fe(OH)3, Cu(OH)2, Al(OH)3…
Bazo mạnh, bazo yếu
+) Một số Bazo mạnh như: NaOH, KOH,…
+) Một số Bazo yếu như: Al(OH) , Fe(OH) , Cu(OH) ,…
Tính chất hóa học của bazo
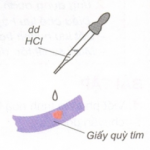
Tác dụng với chất chỉ thị màu.
+) Dung dịch bazơ làm quỳ tím đổi thành màu xanh.
+) Dung dịch bazơ làm phenolphtalein không màu đổi sang màu đỏ.
Tác dụng của dung dịch bazơ với oxit axit
+) Dung dịch :
bazơ (kiềm) + oxit axit → muối + nước
Ví dụ:
2NaOH + SO2 → Na2SO3 + H2O
Ba(OH)2 + CO2 → BaCO3 ↓ + H2O
Tác dụng của bazơ với axit:
+) Dung dịch
Bazơ + axit → muối + nước
Ví dụ:
NaOH + HCl → NaCl + H2O
Cu(OH)2 + 2HNO3 → Cu(NO3)2 + H2O
+) Phản ứng giữa bazơ và axit được gọi là phản ứng trung hòa.
Tác dụng của dung dịch bazơ với dung dịch muối
+) Dung dịch bazơ tác dụng được với nhiều dung dịch muối tạo thành muối mới và bazơ mới.
Ví dụ:
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
Ba(OH)2 + Na2CO3 → BaCO3 (↓) + 2NaOH
Bazo không tan bị nhiệt phân hủy
+) Bazơ không tan bị nhiệt phân hủy tạo thành oxit và nước.
Ví dụ:
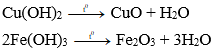
Lưu ý: Điều kiện để có phản ứng xảy ra: Muối tạo thành phải là muối không tan hoặc bazơ tạo thành phải là bazơ không tan.
Các dạng bài tập áp dụng tính chất hóa học của bazo thường gặp
Bài 1: Có phải tất cả các chất kiềm đều là bazơ không? Dẫn ra công thức hóa học của vài ba chất kiềm.
Có phải tất cả các bazơ đều là chất kiềm không? Dẫn ra công thức hóa học của những bazơ để minh họa.
Giải:
Kiềm (hay còn gọi là dung dich bazo) là các bazo tan được trong nước nên:
+) Tất cả các chất kiềm đều là bazơ. Ví dụ: NaOH, Ba(OH)2, KOH.
+) Không phải tất cả các bazơ đều là chất kiềm. Ví dụ: Al(OH)3, Cu(OH)2, Fe(OH)3 … Vì các bazơ này đều là bazơ không tan.
Bài 2: Có những bazơ sau: Cu(OH)2, NaOH, Ba(OH)2. Hãy cho biết những bazơ nào:
a) Tác dụng được với dung dịch HCl?
b) Bị nhiệt phân hủy?
c) Tác dụng được với CO2?
d) Đổi màu quỳ tím thành xanh?
Viết các phương trình hóa học.
Giải:
a) Tất cả các bazơ đã cho đều phản ứng với dung dịch HCl.
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
NaOH + HCl → NaCl + H2O
Ba(OH)2 + 2HCl → BaCl2 + H2O
b) Bị phân hủy ở nhiệt độ cao là các bazo không tan : Cu(OH)2
Cu(OH)2 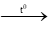
c) Tác dụng với CO2 là các dung dịch bazo (kiểm) NaOH, Ba(OH)2
CO2 + NaOH → NaHCO3
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + Ba(OH)2 → BaCO3 ↓ + H2O
2CO2 + Ba(OH)2 → Ba(HCO3)2
d) Đổi màu quỳ tím thành xanh: các kiềm NaOH, Ba(OH)2.
Bài 3: Từ những chất có sẵn là: Na2O, CaO, H2O. Hãy viết các phương trình hóa học điều chế các dung dịch bazơ.
Giải:
Điều chế các dung dịch bazơ (kiềm):
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2.
Bài 4: Có 4 lọ không nhãn, mỗi lọ đựng một dung dịch không màu sau: NaCl, Ba(OH)2 và Na2SO4. Chỉ được dùng quỳ tím, làm thế nào nhận biết dung dịch đựng trong mỗi lọ bằng phương pháp hóa học? Viết các phương trình hóa học.
Giải:
Trích mẫu thử và đánh số thứ tự:
– Cho quỳ tím vào từng mẫu thử của các dung dịch trên, kết quả chia làm hai nhóm:
• Nhóm I: Quỳ tím đổi màu thành xanh: Ba(OH)2 và NaOH.
• Nhóm II: Quỳ tím không đổi màu: NaCl và Na2SO4.
– Phân biệt các chất trong các nhóm: Lấy từng chất của nhóm I đổ vào từng chất của nhóm II, ta nhận thấy có hai chất đổ vào nhau cho kết tủa trắng là Ba(OH)2 và Na2SO4 hai chất còn lại không phản ứng là NaOH và NaCl.

PTHH: Ba(OH)2 + Na2SO4 → BaSO4 ↓ + 2NaOH.
Bài 5: Cho 15,5g natri oxit Na2O tác dụng với nước, thu được 0,5 lít dung dịch bazơ.
a) Viết phương trình hóa học và nồng độ mol của dung dịch bazơ thu được.
b) Tính thể tích dung dịch H2SO4 20%, có khối lượng riêng 1,14 g/ml cần dùng để trung hòa dung dịch bazơ nói trên.
Giải:
![]()
a) Phương trình hóa học:
Na2O + H2O → 2NaOH
Theo pt: nNaOH = 2.nNa2O = 0,25 . 2 = 0,5 mol.
![]()
b) Phương trình hóa học:
2NaOH + H2SO4 → Na2SO4 + 2H2O
Theo pt:
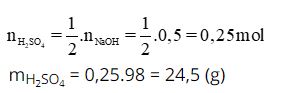
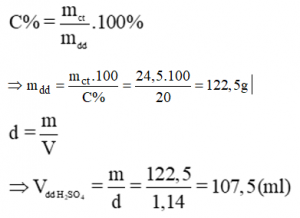
Mong rằng những nội dung trên đây sẽ giúp bạn trả lời được những thắc mắc câu hỏi của mình. Hơn hết đó là có thể giải được những bài toán của mình