Phản ứng hóa học là gì? Khi nào phản ứng hóa học xảy ra và các dạng bài tập
Hóa học là bộ môn mà các em được học khi bước vào lớp 8 và sẽ đồng hành trong suốt những năm học còn lại của cấp 2 và cấp. Hóa học nói về các nguyên tố hóa học, hợp chất,… và sự phản ứng của các chất với nhau. Vậy, phản ứng hóa học là gì? Lớp 8, có các loại phản ứng hóa học thường gặp nào? Các em hãy cùng chúng tôi tìm hiểu qua bài viết sau.
Tham khảo thêm:
- Metan là gì? Tính chất hóa học, công thức tổng quát, cách điều chế Metan kèm bài tập từ A -Z
- Định nghĩa, tính chất hóa học và công thức tổng quát của Axit Cacbonic và muối cacbonat kèm VD
- Ankađien là gì? Công thức tổng quát, cách điều chế và tính chất hóa học của ankađien kèm theo bài tập mình họa
Nội Dung
Phản ứng hóa học là gì?
+) Phản ứng hóa học là quá trình biến đổi từ chất này sang chất khác.
-Chất ban đầu bị biến đổi trong phản ứng gọi là chất phản ứng hay chất tham gia.
-Chất mới sinh ra gọi là sản phẩm.
– Phương trình chữ của phản ứng hóa học: Tên các chất tham gia → Tên các sản phẩm
Có mấy loại phản ứng hóa học?
Phản ứng hóa học có 4 loại bao gồm: Phản ứng hóa hợp, phản ứng phân hủy, phản ứng oxi hóa khử và phản ứng thế.Cụ thể:
+) Phản ứng hóa hợp: Là một phản ứng hóa học, trong đó hai hay nhiều chất ban đầu chỉ tạo thành một chất mới (sản phẩm).
Ví dụ: 2Mg + O2 -> 2MgO
+) Phản ứng phân hủy: Là phản ứng hóa học trong đó có nhiều chất mới được sinh ra (2 chất trở lên từ một chất ban đầu.
Ví dụ: Zn(OH)2 -> ZnO + H2O
+) Phản ứng oxi hóa khử: Là phản ứng hóa học khi sự khử và oxi hóa xảy ra đồng thời.
Ví dụ: Fe2O3 + 3CO -> 2Fe + 3CO2
+) Phản ứng thế: Là một phản ứng hóa học xảy ra giữa đơn chất và hợp chất trong đó nguyên tử của đơn chất sẽ thay thế cho nguyên tử của một nguyên tố khác trong hợp chất.
Ví dụ: Cl2 + 2KBr -> 2KCl + Br2
– Cách đọc phương trình chữ của phản ứng hóa học:
- Dấu “+” ở trước phản ứng đọc là “tác dụng với” hay “phản ứng với”
- Dấu “+” sau phản ứng đọc là “và”
- Dấu “→” đọc là “tạo thành” hay “tạo ra” hoặc “phân hủy ra”
– Trong quá trình phản ứng lượng chất tham gia giảm dần còn lượng chất sản phẩm tăng dần.
Diễn biến của phản ứng hóa học
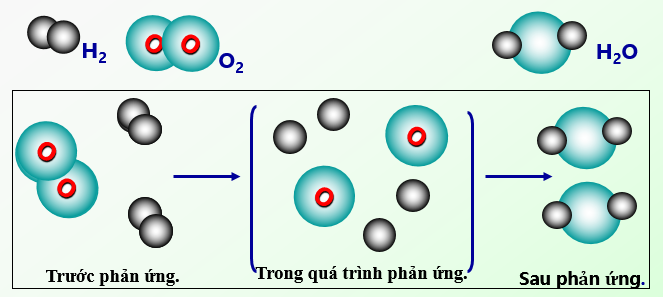
⇒ Trong các phản ứng hóa học, chỉ có liên kết giữa các nguyên tử thay đổi làm cho phân tử này biến đổi thành phân tử khác.
Lưu ý:
- Nếu có đơn chất kim loại tham gia phản ứng thì sau phản ứng nguyên tử kim loại phải liên kết với nguyên tử của nguyên tố khác.
- Nếu đơn chất là kim loại thì nguyên tử kim loại sẽ tham gia phản ứng.
Điều kiện để có phản ứng hóa học xảy ra
- Các chất tham phản ứng phải được tiếp xúc với nhau.
- Tùy mỗi phản ứng cụ thể mà cần đun nóng đến một nhiệt độ nào đó
- Có những phản ứng cần xúc tác thích hợp, đó là chất kích thích cho phản ứng xảy ra nhanh hơn và giữ nguyên không biến đổi khi phản ứng kết thúc.
Dấu hiệu có thể nhận biết phản ứng hóa học xảy ra
- Có thể thay đổi màu sắc, trạng thái, mùi.
- Tỏa nhiệt, thu nhiệt hoặc phát sáng.
- Tạo ra kết tủa, bay hơi, hoặc đổi màu
Các dạng bài tập phản ứng hóa học thường gặp
Bài 1: Lập phương trình hóa học biểu diễn phản ứng hóa hợp của lưu huỳnh với các kim loại magie (Mg); kẽm (Zn); sắt (Fe); nhôm (Al). Biết rằng công thức hóa học của chất được tạo thành tương ứng là: MgS; ZnS; FeS; Al2S3
Giải:
Phương trình hóa học là:
S + Mg → MgS
S + Zn → ZnS
S + Fe → FeS
3S + 2Al → Al2S3
Bài 2: Cho 5,68 gam P2O5 vào cốc chứa 50 gam H2O thu được dung dịch axit photphoric (H3PO4). Tính khối lượng dung dịch axit tạo thành.
Giải:
Phương trình hóa học: P2O5 + 3H2O → 2H3PO4
Áp dụng định luật bảo toàn khối lượng có:
mP2O5 + mH2O = mdd axit ⇔ mdd axit = 50 + 5,68 = 55,68 gam.
Bài 3: Cho phản ứng hóa hợp: CaO + H2O → Ca(OH)2. Tính số mol của canxi hiđroxit biết khối lượng của CaO là 5,6 g
Giải:
nCaO = 5,6/56 = 0,1 mol
CaO + H2O → Ca(OH)2
0,1 → 0,1 (mol)
Bài 4: Cho phản ứng: C + O2 → CO2. Phản ứng trên là:
Giải:
Chất mới CO2 được tạo thành từ 2 chất ban đầu là C và O2 => đây là phản ứng hóa hợp. C phản ứng cháy với O2 tỏa nhiều nhiệt.
Bài 5: Trong phòng thí nghiệm, người ta điều chế oxit sắt từ Fe3O4 bằng phản ứng hóa hợp sau: 3Fe + 2O2 → Fe3O4
Giải:
nFe3O4 = 2,32/232 = 0,01 mol
Phương trình hóa học:
3Fe + 2O2 
0,02 ← 0,01(mol)
nO2 = 0,02 mol; Số gam oxi: mO2 = 32.0,02 = 0,64g
Bài 6: Cho m gam hỗn hợp X gồm Cu, Fe vào dung dịch HCl dư, thu được 8,96 lít khí H2 (đktc). Cũng cho m gam hỗn hợp X trên vào dung dịch H2SO4đặc, nóng dư, thoát ra 20,16 lít khí SO2 (đktc). Giá trị của m là
Giải:
Fe + 2HCl → FeCl2+H2
2Fe + 6H2SO4 → Fe2 (SO4)3+3SO2+6H2O
Cu + 2H2SO4 → CuSO4+SO2+2H2O
nH2 = 0,4 mol ⇒ nFe = 0,4 mol
nSO2 = 0,9 mol. BT e ⇒ 3.nFe + 2.nCu = 2.nSO2 =0,9.2 =1,8 mol
⇒ nCu = (1,8 – 3.0,4)/2 = 0,3 mol
m = 0,4.56 + 0,3.64 = 41,6(g)
Bài 7: Cho từng chất: C, Fe, BaCl2, Fe3O4, Fe2O3, FeCO3, Al2O3, H2S, HI, HCl, AgNO3, Na2SO3 lần lượt phản ứng với H2SO4đặc, nóng. Số phản ứng thuộc loại phản ứng oxi hóa – khử là
Giải:
Số chất phản ứng với H2SO4 đặc, nóng là phản ứng oxi hóa khử là: C, Fe, Fe3O4, FeCO3, H2S, HI
C + 2H2SO4 → 2SO2 + CO2 + 2H2O
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
2Fe3O4 + 10H2SO4 → 3Fe2(SO4)3 + SO2 + 10H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
3H2S + H2SO4 → 4S + 4H2O
8HI + H2SO4 → 4I2 + H2S + 4H2O
Bài 8: Hòa tan hoàn toàn x mol CuFeS2 bằng dung dịch HNO3 đặc, nóng (dư) sinh ra y mol NO2 (sản phẩm khử duy nhất của N+5). Biểu thức liên hệ giữa x và y là
Giải:
CuFeS2 → Cu2+ + Fe3+ + 2S+6 + 17e
x 17x
N+5 + 1e → N+4
y y
BT e ⇒ 17x = y
CuFeS2 + 22HNO3 Cu(NO3)2 + Fe(NO3)3 + 2H2SO4 + 17NO2 + 9H2O
Bài 8. Cho 24,6 gam hỗn hợp Mg, Al, Fe phản ứng hết với dung dịch HCl thu được 84,95 gam muối khan. Thể tích H2 (đktc) thu được bằng:
Giải:
Ta có: mmuối = mkim loại + 71. ⇒ 84,95 = 24,6 + 71.nH2
⇒nH2= 0,85 mol ⇒ VH2= 19,04 mol.)
Bài 9.Cho 5,1 gam hai kim loại Al và Mg tác dụng với HCl dư thu được 5,6 lít khí H2 (đktc). Thành phần phần trăm theo khối lượng của Al là:
Giải:
nH2 = 5,6/22,4= 0,25 mol
Ta có: 27.nAl +24.nMg =5.1 (1)
BT e :
Al → Al3+ + 3e
Mg → Mg2+ + 2e
H+ + 2e → H2
⇒ 3.nAl + 2.nMg =2.nH2 = 2.0,25 = 0,05 (2)
Từ (1) và (2) ⇒ nAl = nMg =0,1 ⇒ %mAl = 52,94%
Bài 10: Cho KI tác dụng với KMnO4 trong môi trường H2SO4, thu được 1,51 gam MnSO4. Số mol I2 tạo thành và KI tham gia phản ứng là
Giải;
nMnSO4 = 0,01 mol, nI2 = x mol
2I– → I2 +2e
2x x 2x
Mn+7 +5e → Mn+2
0,05 0,01
BT e ⇒ 2.x = 0,05 ⇒ x = 0,025 mol
nI2 = 0,025 mol , nKI = 0,05 mol.
Mong rằng những nội dung trên đây sẽ giúp bạn trả lời được những thắc mắc câu hỏi của mình. Hơn hết đó là có thể giải được những bài toán của mình