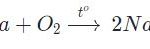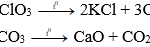Tính chất hóa học của clo và các dạng bài tập liên quan chuẩn 100%
Tính chất hóa học cơ bản của Clo có những đặc trưng của một phi kim tương đối mạnh và gây độc. Hiện nay, trong cuộc sống ta rất dễ bắt gặp những sản phẩm có ứng dụng từ hoá chất này. Vậy hôm nay hãy cùng THPT Chuyên Lam Sơn đi tìm hiểu xem Clo là gì? Tính chất hoá học của Clo và lý giải tại sao Clo lại có tính ứng dụng cao đến vậy.
Tham khảo thêm:
- Tính chất hóa học của bazo và các dạng bài tập liên quan chuẩn 100%
- Tính chất hóa học của axit và các dạng bài tập liên quan chuẩn 100%
- Tính chất hóa học của nước và các dạng bài tập liên quan chuẩn 100%
Nội Dung
Clo là gì?
Clo hay còn gọi là Chlorine là một chất hoá học tồn tại ở thể khí, màu vàng đục, mùi hắc và nặng gấp 2.5 lần không khí.
Ký hiệu hoá học là: Cl2
Tính chất hoá học của clo
Tác dụng với kim loại
Đa số kim loại và có to để khơi màu phản ứng tạo muối clorua (có hoá trị cao nhất)
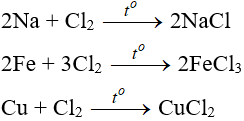
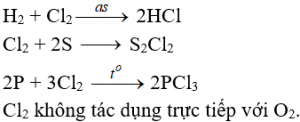
Tác dụng với phim kim
Cần có nhiệt độ hoặc có ánh sáng
Tác dụng với nước và dung dịch kiềm
Cl2 tham gia phản ứng với vai trò vừa là chất ôxi hóa, vừa là chất khử.
Tác dụng với nuớc
Khi hoà tan vào nước, một phần Clo tác dụng (Thuận nghịch)
Cl20 + H2O → HCl + HClO (Axit hipoclorơ)
Axit hipoclorơ có tính oxy hoá mạnh, nó phá hửy các màu vì thế nước clo hay clo ẩm có tính tẩy màu do.
Tác dụng với dung dịch bazơ
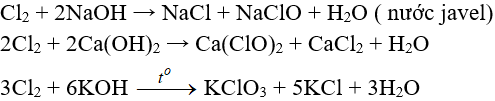
Tác dụng với muối của các halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3
Cl2 + 2KI → 2KCl + I2
Tác dụng với chất khử khác
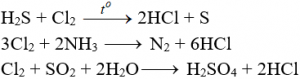
Phản ứng thế, phản ứng cộng, phản ứng phân huỷ với một số hợp chất hữu cơ
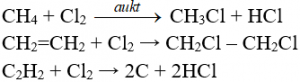
Tính chất vật lý của Clo
– Clo là chất khí, màu vàng, mùi xốc, độc và nặng hơn không khí.
– Cl2 có một liên kết cộng hóa trị, dễ dàng tham gia phản ứng,là một chất oxi hóa mạnh.
– Tham gia các phản ứng Clo là chất oxi hoá, tuy nhiên clo cũng có khả năng đóng vai trò là chất khử
Cách điều chế Clo
Trong tự nhiên, Clo chỉ tồn tại ở dạng hợp chất. Vì vậy người ta thường sử dụng các hợp chất của nó để điều chế.
Cách điều chế Clo trong phòng thí nghiệm
Để điều chế khí Clo trong phòng thí nghiệm, thực hiện đun nóng nhẹ dung dịch HCl đậm đặc với chất oxi hóa mạnh, ví dụ như mangan (IV) oxit (MnO2) hoặc KMnO4. Quan sát sẽ thấy khí màu vàng lục, mùi hắc xuất hiện. Khí Clo được làm khô bằng axit sunfuric H2SO4 đặc và thu vào bình bằng cách đẩy không khí.
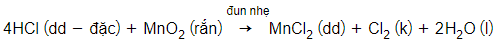
Trong phản ứng trên MnO2 có màu đen; MnCl2 không màu; Cl2 có màu vàng lục.
Cách điều chế Clo trong công nghiệp
Trong công nghiệp, khí Clo được điều chế bằng phương pháp điện phân dung dịch natri clorua (NaCl) bão hòa có màng ngăn xốp. Khí Clo thu được ở cực dương, khí hidro thu được ở cực âm, dung dịch là NaOH.
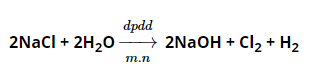
Các dạng bài tập áp dụng tính chất hóa học của clo thường gặp
Bài 1: Cho 10,8g kim loại M có hóa trị III tác dụng với clo dư thì thu được 53,4g muối. Hãy xác định kim loại M đã dùng.
Giải:
Gọi M là khối lượng mol của kim loại
2M + 3Cl2 → 2MCl3
10,8 g 53,4 g
Theo pt: nM = nMCl3 ⇒ 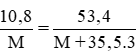
⇒ M = 27 (g). Vậy M là nhôm (Al)
Bài 2: Nếu tính chất hóa học của clo. Viết các phương trình hóa học minh họa.
Giải:
Phương trình hóa học của clo.
– Tác dụng với kim loại: 3Cl2 (k) + 2Fe (r ) 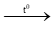
– Tác dụng với hiđro: Cl2 (k) + H2 (k) 
– Tác dụng với nước: Cl2(k) + H2O ↔ HCl(dd) + HClO(dd).
– Tác dụng với dung dịch NaOH:
Cl2 (k) + 2NaOH(dd) → NaCl(dd) + NaClO(dd) + H2O(1)
Bài 3: Viết phương trình hóa học khi cho clo, lưu huỳnh, oxi với sắt ở nhiệt độ cao. Cho biết hóa trị của sắt trong những hợp chất tạo thành.
Giải:
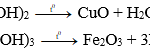
a) 2Fe(r) + 3Cl2 → 2FeCl3 (r) (Fe hóa trị III)
b) Fe(r) + S (r) → FeS (r) (Fe hóa trị II )
c) 3Fe (r) + 2O2 → Fe3O4(r) (Fe hóa trị III và II).
Nhận xét:
– Clo đưa Sắt lên hóa trị cao nhất là III trong hợp chất FeCl3
– Trong hợp chất Fe3O4 sắt thể hiện cả hóa trị II và hóa trị III
– Lưu huỳnh tác dụng với Sắt tạo hợp chất FeS, trong đó Fe có hóa trị II. Như vậy mức độ hoạt động của các phi kim được sắp xếp theo chiều giảm dần như sau: Cl, O, S.
Bài 4: Sau khi làm thí nghiệm, khí clo dư được loại bỏ bằng cách sục khí clo vào:
Giải:
Trường hợp đúng là b). Vì dung dịch này phản ứng được với khí Clo tạo thành muối.
Cl2 (k) + 2NaOH(dd) → NaCl(dd) + NaClO(dd) + H2O(1)
Bài 5: Dẫn khí clo vào dung dịch KOH tạo thành dung dịch hai muối. Viết các phương trình hóa học.
Giải:
Phương trình phản ứng:
Cl2 + 2KOH → KCl + KClO + H2O.
Bài 6: Có ba khí được đựng riêng biệt trong ba lọ: clo, hiđrua clorua, oxi. Hãy nêu ba phương pháp hóa học để nhận biết từng khí đựng trong ba lọ.
Giải:
Lấy mẫu thử từng khí:
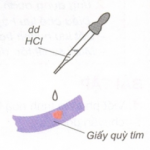
– Dùng quỳ tím ẩm cho vào các mẫu thử:
+ Nhận biết được khí clo: làm mất màu giấy quỳ tím ẩm
+ Nhận ra được khí hiđro clorua: làm quỳ tím ẩm hóa đỏ.
+ Không có hiện tượng gì là khí oxi
(Hoặc Dùng tàn đóm ta nhận biết khí oxi: oxi làm tàn đóm bùng cháy.)
Bài 7 Cần bao nhiêu gam KMnO4 và bao nhiêu ml dung dịch axit clohiđric 1M để điều chế khí clo tác dụng với sắt, tạo nên 16,25g FeCl3?
Giải:
– Theo bài ra, ta có: nFeCl3 = m/M = 16,25/162,5 = 0,1 (mol)
– Phương trình hóa học của phản ứng:
3Cl2 + 2Fe → 2FeCl3
Theo PTPƯ: nCl2 = (3/2).nFe = (3/2).0,1 = 0,15 (mol)
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Theo PTPƯ: nKMnO4 = (2/5).nCl2 = (2/5).0,15 = 0,06 (mol)
nHCl = (16/5).nCl2 = (16/5).0,15 = 0,48 (mol).
mKMnO4 cần = 0,06. 158 = 9,48 (g).
⇒ Vdd HCl = n.CM = 0,48.1 = 0,48 (lít).
Mong rằng những nội dung trên đây sẽ giúp bạn trả lời được những thắc mắc câu hỏi của mình. Hơn hết đó là có thể giải được những bài toán của mình