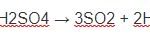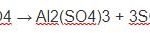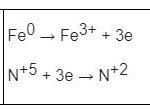Lý thuyết FeS2 + HNO3→ Fe(NO3)3 + H2SO4 + NO + H2O và bài tập có đáp án
FeS2 + HNO3→ Fe(NO3)3 + H2SO4 + NO + H2O là phản ứng oxi hóa khử được chung tôi biên soạn, phương trình này sẽ xuất hiện trong nội dung các bài học Hóa học 10, cũng như các dạng bài tập. Mời các bạn tham khảo.
Tham khảo thêm:
- FeCl3 + NaOH → Fe(OH)3 + NaCl
- NaHCO3 + HCl → NaCl + CO2 + H2O
- CH3CHO + AgNO3 + NH3+ H2O → CH3COONH4 + NH4NO3 + Ag
3FeS2 + 26HNO3→ 3Fe(NO3)3 + 6H2SO4 + 17NO + 7H2O
Điều kiện để FeS2 + HNO3: Không có
Cách tiến hành để FeS2 + HNO3: Cho FeS2 tác dụng với acid HNO3.
Hiện tượng phản ứng hóa học cho FeS2 tác dụng với acid HNO3: Sau phản ứng xuất hiện khí không màu (NO) hóa nâu trong không khí
Nội Dung
Cân bằng phản ứng FeS2 + HNO3
FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + NO + H2O
+) Xác định sự thay đổi số oxi hóa:
Fe+2 → Fe+3
S-2 → S+6
N+5→ N+2
(Viết số oxi hóa này phía trên các nguyên tố tương ứng)
+) Lập thăng bằng electron:
Fe+2 → Fe+3 + 1e
S-2 → S+6 + 8e
FeS → Fe+3 + S+6 + 9e
N+5 + 3e → 2N+2
→ Có 3FeS và 9NO.
+) Đặt các hệ số tìm được vào phản ứng và tính các hệ số còn lại:
3FeS2 + 26HNO3 → 3Fe(NO3)3+ 6H2SO4 + 17NO + 7H2O
Bài tập phản ứng FeS2+HNO3
Câu 2. Cho 3,6 gam Mg tác dụng hết với dung dịch HNO3 (dư), sinh ra 2,24 lít khí X (sản phẩm khử duy nhất, đktc). Khí X là:
Giải:
Ta có:
nMg= 3,6/24 = 0,3 mol
nX = 2,24/22,4 =0,1 mol
Mg0 → Mg+2 +2e
0,15 → 0,3
N+5 + (5 – n) e → N+n
0,3 → 0,1
=> 0,1 (5-n) = 0,3 => n = 2 => NO
Câu 2. Cho m (g) hỗn hợp Fe và Cu tác dụng hết với 100 ml dung dịch HNO3 2,4 M có nung nóng thu được dung dịch A và một khí màu nâu đỏ. Cô cạn dung dịch A thu được 10,48 g hỗn hợp 2 muối khan. Giá trị của m (g)?
Giải:
nHNO3 = 0,1.2,4 = 0,24 mol;
2H+ + NO3– + e → NO2 + H2O
nNO3- tạo muối = 0,12 mol
mmuối = m + mNO3– = m + 0,12.62 ⇒ m = 10,48 – 7,44 = 3,04 gam
Câu 3. Hòa tan hoàn toàn hh X gồm 8,1 gam Al và 29,25 gam Zn bằng dd HNO3 12,6% (vừa đủ) thu được V lit N2O (đktc, khí duy nhất) và dung dịch Y chứa 154,95 gam muối tan. Giá trị của V là
Giải:
mAl(NO3)3 = 8,1.213/27 = 63,9 gam; mZn(NO3)3 = 29,25.189/65 = 85,05 gam
my = mAl(NO3)3 + mZn(NO3)2 + mNH4NO3 ⇒ mNH4NO3 = 6 gam ⇒ nNH4NO3 = 0,075 mol
nN2O = (0,3.3 + 0,45.2 – 0,075.8)/8 = 0,15 mol ⇒ V = 0,15.22,4 = 3,36 lít
Câu 4. Hòa tan 38,4 gam Cu vào dung dịchHNO3 loãng dư, thu được V lít khí NO (đktc, sản phẩm khử duy nhất). Giá trị của V:
Giải:
Sử dụng bảo toàn e: nNO = 38,4/64 . 2/3 = 0,4 mol ⇒ V = 0,4.22,4 = 8,96 lít
Câu 5. Dãy kim loại nào dưới đây không phản ứng với axit HNO3 đặc nguội?
A. Cu, Fe, Ag
B. Cu, Fe, Cr
C. Cr, Fe, Al
D. Fe, Cr, Ag
Giải:
Al, Fe, Cr là những kim loại bị thụ động với HNO3 đặc nguội
Sau khi đọc xong bài viết của chúng tôi bạn có thể biết được FeS2 + HNO3 để vận dụng vào làm các bài tập từ cơ bản đến nâng cao nhanh chóng nhé