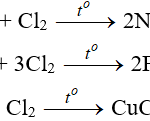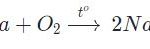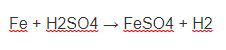Tính chất hóa học của cacbon và các dạng bài tập liên quan chuẩn 100%
Cacbon là một phi kim khá quen thuộc và có nhiều ứng dụng quan trong trong đời sống, sản xuất. Cacbon là nguyên tố phổ biến trong hầu hết các sự sống hữu cơ. Vậy bạn đã hiểu gì về nguyên tố này. Hãy cùng chúng tôi tìm hiểu những tính chất hóa học của cacbon cũng như ứng dụng của nó. Bên cạnh đó là những dạng thù hình của cacbon các bạn nhé!
Tham khảo thêm:
- Tính chất hóa học của muối và các dạng bài tập liên quan chuẩn 100%
- Tính chất hóa học của kim loại và các dạng bài tập liên quan chuẩn 100%
- Tính chất hóa học của axit và các dạng bài tập liên quan chuẩn 100%
Nội Dung
Cacbon là gì?
Cacbon là nguyên tố hóa học bắt nguồn từ tiếng Pháp carbone, ký hiệu hóa học là C, số nguyên tử bằng 6, nguyên tử khối bằng 12. Đây là nguyên tố phi kim có hóa trị IV phổ biến. Nguyên tố này cũng có nhiều dạng hình thù khác nhau
- Cacbon ở ô thứ 6, chu kỳ 2, nhóm IVA của bảng tuần hoàn
- Cấu hình e: 1s22s22p2. C có 4 electron lớp ngoài cùng.
- Các số oxi hóa của C là: -4, 0, +2, +4.
Cacbon tồn tại chủ yếu trong mọi sự sống hữu cơ, là nền tảng của hóa học hữu cơ. Đây là loại phi kim đặc biệt, có khả năng tự liên kết với chính nó và liên kết với một loạt những nguyên tố khác, kết quả tạo ra gần 10 triệu hợp chất đã biết.
Tính chất hóa học của cacbon
+) Trong các dạng tồn tại của C, C vô định hình hoạt động hơn cả về mặt hóa học.
+)Trong các phản ứng hóa học C thể hiện hai tính chất: Tính oxi hóa và tính khử. Tuy nhiên tính khử vẫn là chủ yếu của C.
Tính khử của cacbon
+) Tác dụng với oxi
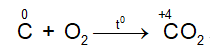
Ở nhiệt độ cao C lại khử CO2 theo phản ứng:
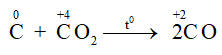
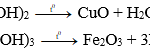
+) Tác dụng với oxit kim loại:
C khử được oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại:
CuO + C → Cu + CO (tº)
Fe2O3 + 3C → 2Fe + 3CO (tº)
+) Tác dụng với CaO và Al2O3:
CaO + 3C → CaC2 + CO (trong lò điện)
2Al2O3 + 9C → Al4C3 + 6CO (2000ºC)
+) Tác dụng với các chất oxi hóa mạnh thường gặp H2SO4 đặc, HNO3, KNO3, KClO3, K2Cr2O7, … trong các phản ứng này, C bị oxi hóa đến mức +4 (CO2).
C + 2H2SO4 đặc → CO2 + 2SO2 + 2H2O (tº)
C + 4HNO3 đặc → CO2 + 4NO2 + 2H2O (tº)
C + 4KNO3 → 2K2O + CO2 + 4NO2 (tº)
+) Khi nhiệt độ cao, C tác dụng được với hơi nước:
C + H2O → CO + H2 (1000ºC)
C + 2H2O → CO2 + 2H2
Tính oxi hóa của cacbon
+) Tác dụng với hidro
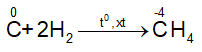
+) Tác dụng với kim loại
![]()
Các dạng bài tập áp dụng tính chất hóa học của cacbon thường gặp
Bài 1: Sục 4,48l khí CO2 (đktc) vào 500ml dd NaOH 0,1M và Ba(OH)2 0,2M. Tính m kết tủa thu được?
Giải:
nCO2 = 0,2 mol, nOH– = 0,25 mol, nBa2+ = 0,1 mol
CO2 + 2OH– → CO32- + H2O
0,125 0,25 → 0,125
CO2 + CO32- + H2O → 2HCO3–
0,075 →0,075 → 1,5
nCO32- = 0,05mol
Ba2+ + CO32- → BaCO3
0,05 0,05
⇒ m↓ = 0,05 . 197 = 9,85g
Bài 2: Cho các chất: O2 (1),CO2 (2), H2 (3), Fe2O3 (4), SiO2 (5), HCl (6), CaO (7), H2SO4 đặc (8), HNO3 (9), H2O (10), KMnO4 (11). Cacbon phản ứng trực tiếp được với bao nhiêu chất?
Giải:
(1) C + O2 → CO2
(2) C + CO2 → 2CO
(3) C + 2H2 −tº→ CH4
(4) Fe2O3 + 3C −tº→ 2Fe + 3CO
(5) 2C + SiO2 −tº→ Si + 2 CO
(7) CaO + 3C → CaC2 + CO (trong lò điện)
(8) C + 2H2SO4 đặc −tº→ CO2 + 2SO2 + 2H2O
(9) C + 4HNO3 đặc −tº→ CO2 + 4NO2 + 2H2O
(10) C + 2H2O → CO2 + 2H2
Bài 3: Sục 3,36 lít khí CO2 (đktc) vào 300ml dd Ca(OH)2 0,2M và NaOH 0,3 M thu được m (g) kết tủa và dd Y. Cô cạn dd Y thu được m’( g) chất rắn khan. Tìm m và m’ ?
Giải:
nCO2 = 0,15 mol, nOH– = 0,21 mol, nCa2+ = 0,06 mol
CO2 + 2OH– → CO32- + H2O
0,105 0,21 → 0,105
CO2 + CO32- + H2O → 2HCO3–
0,045 → 0,045 → 0,09
nCO32- = 0,06mol
Ca2+ + CO32- → CaCO3
0,06 0,06 0,06
⇒ m↓ = 6g
Dd ⇒ mcrắn = 0,09 . 84 = 7,56g
Bài 4: Khử 16g hỗn hợp các oxit kim loại: FeO, Fe2O3, Fe3O4, CuO, PbO bằng khí CO ở nhiệt độ cao, khối lượng chất rắn thu được là 11,2 g. Tính thể tích khi CO đã tham gia phản ứng (đktc)
Giải:
Áp dụng ĐLBT khối lượng
nCO2 = nCO = x mol
moxit + mCO = mCR + mCO2
16 + 28x = 11,2 + 44x ⇒ x=0,3
⇒ VCO = 6,72 lit
Bài 5: Dẫn một luồng khí CO dư qua ống sứ đựng Fe3O4 và CuO nung nóng đến khi phản ứng hoàn toàn thu được 2,32 gam hỗn hợp kim loại. Khí thoát ra khỏi bình được dẫn qua dung dịch nước vôi trong dư thu được 5 gam kết tủa. Tính tổng khối lượng 2 oxit trong hỗn hợp đầu.
Giải:
Phương trình phản ứng:
4CO + Fe3O4 → 4CO2↑ + 3Fe
CO + CuO → CO2↑ + Cu
CO2 + Ca(OH)2 → CaCO3↓ + H2O
nCO2 = nCaCO3 = 5/100 = 0,05 mol
Áp dụng định luật bảo toàn nguên tố C ta có: nCO = nCO2 = 0,05 mol
Áp dụng định luật bảo toàn khối lượng ta có: moxit kl + mCO = mkl + mCO2
⇒ moxit kl = 2,32 + 0,05.44 – 0,05,28 = 3,12 gam
Bài 6: Khử hoàn toàn 32,20 gam hỗn hợp gồm CuO, Fe2O3 và ZnO bằng CO ở nhiệt độ cao thu được 25,00 gam hỗn hợp X gồm 3 kim loại. Cho X tác dụng vừa đủ với dung dịch HNO3 thì thu được V lít khí NO duy nhất (đktc) và dung dịch chứa m gam muối (không chứa NH4NO3). Tính thể tích khí NO thoát ra và m gam muối thu được
Giải:
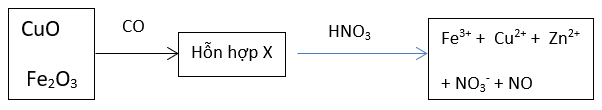
Ta có: nCO = nCO2 = x mol
Áp dụng định luật bảo toàn khối lượng : moxit kl + mCO = mkl + mCO2
⇔ 32,2 + 28x = 25 + 44x ⇒ x = 0,45 mol
Trong quá trình phản ứng chỉ có sự thay đỏi số oxi hóa của C và N.
Phương trình cho nhận e: C+2 – 2e → C+4 ; N+5 + 3e → N+2
Áp dụng bảo toàn e cho toàn quá trình ta có: 0,45.2 = 3.nNO ⇒ nNO = 0,3 mol
Vậy thể tích khí NO thu được là V = 0,3.22,4 = 6,72 lít
nNO3– tạo muối = 3nNO = 0,3.3 = 0,9 mol
Khối lượng muối thu được là m = mkl + mNO3– = 25 + 0,9.62 = 80,8 gam.
T = 0,04/0,03 = 4/3 ⇒ tạo 2 muối: Ca(HCO3)2 x mol và CaCO3 y mol
Ta có: x + 2y = 0,03 mol và x + y = 0,02 mol ⇒ x= 0,01 và y = 0,01⇒ m =0,01.100 =1g
Mong rằng những nội dung trên đây sẽ giúp bạn trả lời được những thắc mắc câu hỏi của mình. Hơn hết đó là có thể giải được những bài toán của mình