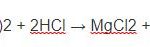Lý thuyết MgO + HCl → MgCl2 + H2O và bài tập có đáp án
Hôm nay THPT Chuyên Lam Sơn sẽ phân tích MgO + HCl → MgCl2 + H2O là phương trình phản ứng magie oxit tác dụng axit clohiric, sản phẩm sau phản ứng thu được muối magie clorua và nước. Mời các bạn tham khảo nội dung chi tiết phương trình phản ứng dưới đây.
Tham khảo thêm:
Nội Dung
Phương trình phản ứng MgO + HCl:
MgO + 2HCl → MgCl2 + H2O
Điều kiện phản ứng MgO + HCl: Nhiệt độ thường
Tiến hành phản ứng MgO tác dụng với HCl
- Cho MgO phản ứng với dung dịch axit HCl.
- MgO tan dần, sau phản ứng thu được dung dịch không màu.
Bài tập phản ứng MgO + HCl
Bài 1: Cho 2,8g hỗn hợp CuO, MgO, Fe2O3 tác dụng vừa đủ với 50 ml dd H2SO4 1M. Cô cạn dung dịch sau phản ứng thu được m gam muối khan. Giá trị của m là:
Giải:
Theo định luật bảo toàn khối lượng ta có:
m3oxit + mH2SO4 = mmuoi + mH2O san pham
⇔ mmuoi = m3oxit + mH2SO4 – mH2O san pham
Mà nH2O san pham = nH2SO4 = 1.0,05 = 0,05 mol
⇒ mmuoi = 2,8 + 0,05.98 – 0,05.18 = 6,8g
Bài 2: Hòa tan hoàn toàn 3,61g hỗn hợp gồm ZnO, CuO, MgO và Fe2O3 cần 150 ml dd H2SO4 0,4M. Cô cạn dd sau phản ứng thu được lượng muối sunfat là::
Giải:
m4oxit + mH2SO4 = mmuoi + mH2O san pham
⇔ mmuoi = m4oxit + mH2SO4 – mH2O san pham
⇔ mmuoi = 3,61 + 0,4.0,15.98 – 0,4.0,15.18
⇔ mmuoi = 8,41g
Bài 3: Cho 5g hỗn hợp bột oxit kim loại gồm ZnO, FeO, Fe2O3, Fe3O4, MgO tác dụng vừa hết với 200ml dd HCl 0,4M thu được dd X. Lượng muối trong dd X là:
Giải:
Ta có:
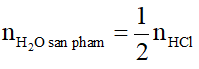
Tương tự bài 1, ta có:
m5oxit + mHCl = mmuoi + mH2O san pham
⇔ mmuoi = m5oxit + mHCl – mH2O san pham
![]()
⇔ mmuoi = 7,2g
Bài 4: Oxy hóa hoàn toàn a(g) hỗn hợp X (gồm Zn, Pb, Ni) được b(g) hỗn hợp 3 oxit Y (ZnO, PbO, NiO). Hòa tan b(g) Y trên trong dung dịch HCl loãng thu được dung dịch Z. Cô cạn Z được hỗn hợp muối khan có khối lượng (b + 55) gam. Khối lượng a(g) của hỗn hợp X ban đầu là:
Giải:
Áp dụng tăng giảm khối lượng, ta thấy 1 nguyên tử O được thay thế bởi 2 nguyên tử Cl.
ZnO, PbO, NiO → ZnCl2, PbCl2, NiCl2
⇒ Từ 1 mol oxit ban đầu khối lượng muối sau phản ứng tăng là:
m↑ = m2Cl – mO = 2.35,5 – 16 = 55g
⇒ mhh ban dau = mFe3O4 + mCu pư + mCu dư = 0,12.232 + 0,12.64 + 8,32 = 43,84g
Theo bài ra, ta có:
m↑ = mmuoi – mhhoxit = (b +55) – b = 55g
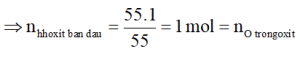
⇒mX = mhhoxit – mO =b-16 = a
Bài 5: Cho m gam hỗn hợp các oxit CuO, Fe2O3, ZnO tác dụng vừa đủ với 50 ml dd HCl 2M. Cô cạn dung dịch sau phản ứng thu được 3,071 g muối clorua. Giá trị của m là:
Giải:
m3oxit + mHCl = mmuoi + mH2O san pham
⇔m3oxit = mmuoi + mH2O san pham – mHCl
![]()
⇔m3oxit = 0,321g
Bài 6: Hòa tan m gam hỗn hợp gồm Cu và Fe3O4 trong dung dịch HCl dư sau phản ứng còn lại 8,32gam chất rắn không tan và dung dịch X. Cô cạn dung dịch X thu được 61,92 gam chất rắn khan. Giá trị của m là:
Giải:
Ta thấy sau phản ứng còn Cu dư, chứng tỏ Fe3O4 tác dụng với HCl tạo 2 muối FeCl3 và FeCl2, sau đó FeCl3 tác dụng hết với Cu tạo FeCl2 và CuCl2.
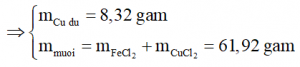
PTHH:
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
x…………………….2x………x
2FeCl3 + Cu → 2FeCl2 + CuCl2
2x……..x…………2x………..x
mmuoi = mFeCl2 + mCuCl2 = (2x+x).127 + x.135 = 61,92g
⇒ x= 0,12 mol
⇒ mhh ban dau = mFe3O4 + mCu pư + mCu dư = 0,12.232+ 0,12.64+ 8,32= 43,84g
Bài 7: Oxi hoá 13,6 gam hỗn hợp 2 kim loại thu được m gam hỗn hợp 2 oxit . Để hoà tan hoàn toàn m gam oxit này cần 500ml dd H2SO4 1M . Tính m:
nH2O san pham = nH2SO4 = 1.0,5 = 0,5 mol = nO/oxit
Theo định luật bảo toàn khối lượng, ta có:
moxit = mKL + mO/oxit =13,6 + 0,5.16 = 21,6g
Bài 8: Đốt cháy hết 2,86 gam hỗn hợp kim loại gồm Al, Fe, Cu được 4,14 gam hỗn hợp 3 oxit. Để hoà tan hết hỗn hợp oxit này, phải dùng đúng 0,4 lít dung dịch HCl và thu được dung dịch X. Cô cạn dung dich X thì khối lượng muối khan là bao nhêu ?
Giải:
Theo định luật bảo toàn khối lượng, ta có:
moxit = mKL + mO/oxit
⇔ mO/oxit = moxit – mKL =44-2,86 = 1,28g
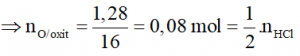
⇒ nHCl = 0,08.2 = 0,16 mol
Áp dụng định luật bảo toàn khối lượng, ta có khối lượng của muối khan thu được là:
mmuoi = mKL + mCl– = 2,86 + 0,16.35,5 = 8,54g
Sau khi đọc xong bài viết của chúng tôi bạn có thể biết được MgO + HCl để vận dụng vào làm các bài tập từ cơ bản đến nâng cao nhanh chóng nhé