Cách lập phương trình hóa học và các dạng bài tập liên quan có lời giải chi tiết từ A-Z
Cách lập phương trình hóa học được chúng tôi sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 8 hiệu quả hơn. Mời các bạn tham khảo.
Tham khảo thêm:
- Định luật bảo toàn khối lượng là gì? Cách tính và công thức kèm theo bài tập có lời giải chuẩn 100%
- Ancol là gì? Tính chất hóa học, công thức, cách điều chế ancol và các dạng bài tập
- Lý thuyết về sự điện li của nước, pH, Chất chỉ thị Axit – bazơ và bài tập có lời giải từ A – Z
Nội Dung
Lập phương trình hóa học là gì?
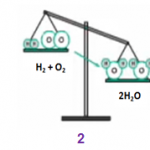
Phương trình hóa học dùng để biểu diễn ngắn gọn phản ứng hóa học. Trong phương trình hóa học, số nguyên tử mỗi nguyên tố trong các chất trước và sau phản ứng giữ nguyên.
Cách lập phương trình hóa học
- Bước 1. Viết sơ đồ của phản ứng, gồm công thức hóa học của các chất phản ứng và sản phẩm.
- Bước 2. Cân bằng số nguyên tử mỗi nguyên tố: Tìm hệ số thích hợp đặt trước các công thức.
- Bước 3. Viết phương trình hóa học.
Lưu ý: Để viết phương trình đúng, tránh những lỗi sai không đáng có, bạn cần chú ý:
- Khí oxi tồn tại ở dạng phân tử O2 vì vậy chúng ta sẽ không viết 6) trong phương trình hóa học. Các bạn không được thay đổi chỉ số trong những công thức hóa học đã viết đúng. Khi viết CTHH, chúng ta viết hệ số cao bằng kí hiệu, không được viết chỉ số nhỏ hơn ký hiệu. Ví dụ về cách viết sai 2Fe (Viết đúng phải là 2Fe).
- Nếu trong CTHH có nhóm nguyên tử (OH), (SO4)… thì coi cả nhóm như một đơn vị để cân bằng. Trước và sau phản ứng số nhóm nguyên tử phải bằng nhau.
Ví dụ: Cho sơ đồ phản ứng sau: Al + HCl → AlCl3 + H2. Lập phương trình hóa học của phản ứng.
Lời giải
Thêm hệ số 2 vào trước AlCl3 để cho số nguyên tử Cl chẵn. Khi đó, vế phải có 6 nguyên tử Cl trong 2AlCl3, nên vế trái thêm hệ số 6 trước HCl.
Al + 6HCl → 2AlCl3 + H2
Vế phải có 2 nguyên tử Al trong 2AlCl3, vế trái ta thêm hệ số 2 trước Al.
2Al + 6HCl → 2AlCl3 + H2
Vế trái có 6 nguyên tử H trong 6HCl, nên vế phải ta thêm hệ số 3 trước H2.
Vậy phương trình hóa học là:
2Al + 6HCl → 2AlCl3 + 3H2
Các bài toán tính theo phương trình hóa học
Tính khối lượng chất tham gia và sản phẩm
Với dạng bài toán này, đề bài sẽ cho trước khối lượng của chất tham gia hay sản phẩm, các em thực hiện tính toán theo các bước sau:
- Bước 1: Chuyển đổi số liệu đầu bài sang số mol.
- Bước 2: Lập phương trình hoá học.
- Bước 3: Dựa vào số mol chất đã biết để tính số mol chất cần tìm theo phương trình hóa học.
- Bước 4: Tính khối lượng các chất cần tìm theo công thức: m = n . M
Nếu phản ứng đã biết khối lượng của (n – 1) chất, cần tính khối lượng của 1 chất còn lại, ta có thể sử dụng định luật bảo toàn khối lượng.
Tính thể tích khí tham gia và tạo thành
Để tính được thể tích khí tham gia và tạo thành, các em cần đi theo các bước như sau:
- Bước 1: Chuyển đổi thể tích chất khí thành số mol chất
- Bước 2: Viết phương trình hóa học
- Bước 3: Dựa vào phương trình phản ứng để tính số mol chất tham gia hoặc sản phẩm
- Bước 4: Áp dụng công thức tính toán theo yêu cầu đề bài
Tính chất dư trong phản ứng
Với dạng bài toán này, các em sẽ biết thể tích hay khối lượng của cả 2 chất tham gia, sau đó tiến hành giải theo các bước sau:

Tính hiệu suất phản ứng
Trong thực tế, một phản ứng hóa học xảy ra phụ thuộc vào rất nhiều yếu tố như chất xúc tác, nhiệt độ,… làm cho chất tham gia phản ứng không tác dụng hết, nghĩa là hiệu suất không đạt 100%. Do đó, hiệu suất phản ứng được tính theo 1 trong 2 cách sau đây:
Cách 1: Tính hiệu suất phản ứng liên quan đến khối lượng sản phẩm:
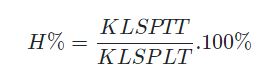
Trong đó:
- KLSPTT là khối lượng sản phẩm thực tế.
- KLSPLT là khối lượng sản phẩm lý thuyết.
Cách 2: Tính hiệu suất phản ứng liên quan đến chất tham gia:

Trong đó:
- KLCTGTT là khối lượng chất tham gia thực tế.
- KLCTGLT là khối lượng chất tham gia lý thuyết.
Lưu ý:
- Khối lượng thực tế sẽ là khối lượng đề bài cho.
- Khối lượng lý thuyết sẽ là khối lượng được tính theo phương trình.
Các dạng bài tập ứng dụng lập phương trình hóa học thường gặp
Câu 1: Cho thanh magie cháy trong không khí thu được hợp chất magie oxit. Biết mMg = 7,2 g. Tính khối lượng hợp chất
Giải:
nMg = 7,2/24 = 0,3 mol
Phương trình hóa học
2Mg + O2 → 2MgO
0,3 → 0,3 mol
mMgO = 0,3.40 = 4,8 g
Câu 2: Cho phương trình CaCO3 → CO2 + H2O
Để điều chế 2,24 l CO2 thì số mol CaCO3 cần dùng là
Giải:
nCO2 = 2,24/22,4 = 0,1 mol
Phương trình hóa học
CaCO3 → CO2 + H2O
0,1 ← 0,1 (mol)
Câu 3: Ba + 2HCl → BaCl2 + H2
Để thu dược 4,16 g BaCl2 cần bao nhiêu mol HCl
Giải:
nBaCl2 = 4,16/208 = 0,02 mol
Phương trình hóa học
Ba + 2HCl → BaCl2 + H2
0,04 ← 0,02 mol
Câu 4: Cho 5,6 g sắt tác dụng với dung dịch axit clohidric loãng thu được bao nhiêu ml khí H2
Giải:
Phương trình hóa học
Fe + 2HCl → FeCl2 + H2
Nhìn vào phương trình thấy nFe = nH2 = 5,6/56 = 0,1 mol
VH2 = 0,1.22,4 = 2,24 l = 2,24.10-3 l
Câu 5: Cho 13,7 g Ba tác dụng với 3,2 g oxi thu được hợp chất oxit. Tính khối lượng oxi sau phản ứng
Giải:
nBa = 13,7/137 = 0,1 mol, nO2 = 3,2/32 = 0,1 mol
Phương trình hóa học
2Ba + O2 → 2BaO
Ban đầu: 0,1 0,1 (mol)
Phản ứng: 0,1 0,05 0,1 (mol)
Sau phản ứng: 0 0,05 0,1 (mol)
Khối lượng oxi sau phản ứng là m = 0,05.32 = 1,6 g
Câu 6: Cho 19,6 g H2SO4 phản ứng với thanh nhôm thấy có khí bay lên. Xác định thể tích khí đó
Giải:
nH2SO4 = 19,6/98 = 0,2 mol
Phương trình hóa học
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
0,2 0,2
VH2 = 0,2.22,4 = 4,48 lít
Câu 7: Cho 8,45 g Zn tác dụng với 5,376 l khí Clo (đktc). Hỏi chất nào sau phản ứng còn dư
Giải:
nZn = 8,45/65 = 0,13 mol
nCl2 = 5,376/22,4 = 0,24 mol
Phương trình hóa học
Zn + Cl2 → ZnCl2
Ban đầu: 0,13 0,24 (mol)
Phản ứng: 0,13 0,13 0,13 (mol)
Sau phản ứng: 0 0,11 0,13 (mol)
Vậy sau phản ứng khí clo dư
Câu 8: Nhiệt phân 2,45 g KClO3 thu được O2. Cho Zn tác dụng với O2 vừa thu được . Tính khối lượng chất thu được sau phản ứng
Giải:
nKClO3 = 2,45/122,5 = 0,02 mol
Phương trình hóa học
2KClO3 → 2KCl + 3O2
0,02 → 0,02 → 0,03 mol
2Zn + O2 → 2ZnO
0,03 → 0,06 mol
Sau phản ứng thu được KCl và ZnO
m = 0,06.81+ 0,02.74,5 = 6,35 g
Mong rằng những nội dung trên đây sẽ giúp bạn trả lời được những thắc mắc câu hỏi của mình. Hơn hết đó là có thể giải được những bài toán của mình