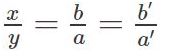Cách cân bằng phương trình hóa học oxi hóa khử và các dạng bài tập có lời giải chi tiết từ A- Z
Cân bằng phương trình hóa học khá đơn giản nhưng có rất nhiều các bạn học sinh còn lúng túng hoặc không biết cách cân bằng phản ứng oxi hóa khử như thế nào? Sau đây, chúng tôi sẽ bật mí 10 cách cân bằng phương trình hóa học chi tiết từ A – Z trong bài viết dưới đây.
Tham khảo thêm:
- Cách cân bằng phương trình hóa học và các dạng bài tập có lời giải chi tiết từ A- Z
- Cấu hình electron nguyên tử là gì? Cách viết cấu hình electron nguyên tử kèm VD minh họa chính xác 100%
- Cấu tạo vỏ nguyên tử là gì? Lý thuyết và các dạng bài tập có lời giải chi tiết từ A – Z
Nội Dung
Cân bằng phương trình hóa học là gì?
Cần bằng phương trình hóa học là một quá trình sử dụng số tự nhiên điền vào trước vị trí các chất tham gia và các chất sản phẩm sao cho tổng số nguyên tử của nguyên tố bên chất tham gia bằng tổng số nguyên tử của nguyên tố đó bên chất sản phẩm.
Quá trình cân bằng phương trình phản ứng là chúng ta sử dụng số tự nhiên trong tập N* điền vào vị trí a, b, c, d để cho các nguyên tố của chất tham gia và chất phản ứng bằng nhau là được.
Lưu ý: Cân bằng phương trình khác với cân bằng hóa học.
Hướng dẫn cách cân bằng phản ứng oxi hóa khử nhanh chóng
Nguyên tắc chung để cân bằng phản ứng oxi hóa khử là số điện tử cho của chất khử phải bằng số điện tử nhận của chất oxi hóa hay số oxi hóa tăng của chất khử phải bằng số oxi hóa giảm của chất oxi hóa.
Phương pháp nguyên tử nguyên tố
Phương pháp này khá đơn giản. Khi cân bằng ta cố ý viết các đơn chất khí (H2, O2, C12, N2…) dưới dạng nguyên tử riêng biệt rồi lập luận số nguyên tử từ chất sản phẩm. Sau đó trả lại bản chất ban đầu của các chất tham gia.
Ví dụ: Cân bằng phản ứng P + O2 → P2O5
Ta viết: P + O → P2O5
Để tạo thành 1 phân tử P2O5 cần 2 nguyên tử P và 5 nguyên tử O:
2P + 5O –> P2O5
Nhưng phân tử oxi bao giờ cũng gồm hai nguyên tử, như vậy nếu lấy 5 phân tử oxi tức là số nguyên tử oxi tăng lên gấp 2 thì số nguyên tử P và số phân tử P2O5 cũng tăng lên gấp 2, tức 4 nguyên tử P và 2 phân tử P2O5
Do đó: 4P + 5O2 –> 2P2O5
Phương pháp dùng hệ số phân số
Phương pháp này áp dụng như sau: Các bạn đặt các hệ số vào các công thức của các chất tham gia phản ứng, không phân biệt số nguyên hay phân số sao cho số nguyên tử của mỗi nguyên tố ở hai vế bằng nhau. Tiếp theo ở tất cả các hệ số bạn sẽ thực hiện khử mẫu só chung
Ví dụ: Cân bằng phản ứng: P + O →P2O
Đặt hệ số để cân bằng: 2P + 5/2O –> P2O
+ Nhân các hệ số với mẫu số chung nhỏ nhất để khử các phân số. Ỏ đây ta nhân 2.
2.2P + 2.5/2O –> P2O
hay 4P + 5O →2 P2O
Phương pháp chẵn–lẻ
Một phản ứng sau khi đã cân bằng thì số nguyên tử của một nguyên tố ở vế trái bằng số nguyên tử nguyên tố đó ở vế phải. Vì vậy nếu số nguyên tử của một nguyên tố ở một vế là số chẵn thì số nguyên tử của nguyên tố đó ở vế kia phải chẵn. Nếu ở một công thức nào đó số nguyên tử của nguyên tố đó còn lẻ thì phải nhân đôi.
Ví dụ: FeS2 + O2 → Fe2O3 + SO2
Ở vế trái số nguyên tử O2 là chẵn với bất kỳ hệ số nào. Ở vế phải, trong SO2 oxi là chẵn nhưng trong Fe2O3 oxi là lẻ nên phải nhân đôi. Từ đó cân bằng tiếp các hệ số còn lại.
2Fe2O3 → 4FeS2 → 8SO2 + 11O2
Đó là thứ tự suy ra các hệ số của các chất. Thay vào PTPU ta được:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Phương pháp hóa trị tác dụng
Hóa trị tác dụng là hóa trị của một nguyên tử hoặc một nhóm nguyên tử của các nguyên tố trong phía chất tham gia và chất sản phẩm của phản ứng hóa học.
Ví dụ: BaCl + Fe (SO4) –> BaSO + FeCl
Hóa trị tác dụng lần lượt từ trái qua phải là:
II – I – III – II – II – II – III – I
Tìm bội số chung nhỏ nhất của các hóa trị tác dụng:
BSCNN(1, 2, 3) = 6
Lấy BSCNN chia cho các hóa trị ta được các hệ số:
6/II = 3, 6/III = 2, 6/I = 6
Thay vào phản ứng: 3BaCl + Fe (SO4) –>3 BaSO + 2FeCl3
Phương pháp xuất phát từ nguyên tố chung nhất
Đối với phương pháp này các bạn bắt đầu cân bằng hệ số các phân tử bằng cách chọn nguyên tố có mặt ở nhiều hợp chất nhất trong phản ứng để bắt đầu cân bằng hệ số các phân tử.
Ví dụ: Cu + HNO3 → Cu(NO3)2 + NO + H2O
Nguyên tố có mặt nhiều nhất là nguyên tố oxi, ở vế phải có 8 nguyên tử, vế trái có 3. Bội số chung nhỏ nhất của 8 và 3 là 24, vậy hệ số của HNO3 là 24 /3 = 8
Ta có 8HNO3 → 4H2O + 2NO (Vì số nguyên tử N ở vế trái chẵn)
3Cu(NO3)2 → 3Cu
Vậy phản ứng cân bằng là:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Phương pháp cân bằng theo nguyên tố tiêu biểu
Nguyên tố tiêu biểu là nguyên tố có đặc điểm sau:
- Có mặt ít nhất trong các chất ở phản ứng đó.
- Liên quan gián tiếp nhất đến nhiều chất trong phản ứng.
- Chưa cân bằng về nguyên tử ở hai vế.
Phương pháp cân bằng này tiến hành qua ba bước:
- a: Chọn nguyên tố tiêu biểu.
- b: Cân bằng nguyên tố tiêu biểu.
- c: Cân bằng các nguyên tố khác theo nguyên tố này
Ví dụ: Cân bằng phản ứng KMnO + HCl –> KCl + MnCl + Cl + H2O
a. Chọn nguyên tố tiêu biểu: O
b. Cân bằng nguyên tố tiêu biểu: KMnO –> 4H2O
c. Cân bằng các nguyên tố khác:
+ Cân bằng H: 4H O –> 8HCl
+ Cân bằng Cl: 8HCl –> KCl + MnCl + 5/2Cl
Ta được:
KMnO + 8HCl –> KCl + MnCl2 + 5/2Cl + 4H2O
Sau cùng nhân tất cả hệ số với mẫu số chung ta có:
2KMnO + 16HCl –> 2KCl + 2MnCl + 5Cl + 8H2O
Phương pháp cân bằng theo trình tự kim loại –phi kim
Theo phương pháp này đầu tiên cân bằng số nguyên tử kim loại, đến phi kim và cuối cùng là H. Sau đó đưa các hệ số đã biết để cân bằng nguyên tử O.
Ví dụ 1: Cân bằng phản ứng NH + O –> NO + H2 O
Ta thấy, phản ứng này không có kim loại, nguyên tử phi kim N đã cân bằng, nên ta cân bằng luôn H:
2NH –> 3H2 O (Tính BSCNN, sau đó lấy BSCNN chia cho các chỉ số để được các hệ số)
+ Cân bằng N: 2NH –> 2NO
+ Cân bằng O và thay vào ta có:
2NH + 5/2O –> 2NO + 3H2 O
Cuối cùng nhân các hệ số với mẫu số chung nhỏ nhất ta được:
4NH + 5O –> 4NO + 6H2 O
Phương pháp cân bằng đại số
Các bạn đặt hệ số a, b, c… lần lượt vào các công thức ở 2 vế của phương trình và thiết lập các phương trình toán học chứa các ẩn trên theo nguyên tắc số nguyên tử của nguyên tố trước và sau phản ứng bằng nhau.
Bạn sẽ được 1 hệ phương trình chứa các ẩn, giải hệ phương trình này và đưa hệ số tương ứng tìm dược vào phương trình phản ứng và khử mẫu (nếu cần).
Ví dụ: a FeS2 + b O2→ c Fe2O3 + d SO2
Ta có: Fe : a = 2c
S : 2a = d
O : 2b = 3c + 2d
Chọn c = 1 thì a=2, d=4, b = 11/2
Nhân tất cả hai vế với 2 ta được phương trình mới
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Phương pháp cân bằng electron
Đây là phương pháp cân bằng áp dụng cho các phản ứng oxi hóa khử. Bản chất của phương trình này dựa trên nguyên tắc: Trong một phản ứng oxi hóa – khử, số electron do chất khử nhường phải bằng số electron do chất oxi hóa thu thực hiện như sau:
- a. Xác định sự thay đổi số oxi hóa.
- b. Lập thăng bằng electron.
- c. Đặt các hệ số tìm được vào phản ứng và tính các hệ số còn lại.
Lưu ý:
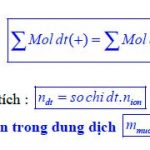
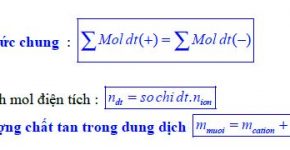
Ngoài phương pháp thăng bằng electron, còn có thể cân bằng phản ứng oxi hóa khử theo phương pháp tăng giảm số oxi hóa với nguyên tắc: tổng số oxi hóa tăng = tổng số oxi hóa giảm.
Phản ứng oxi hóa khử còn có thể được cân bằng theo phương pháp thăng bằng ion electron: lúc đó vẫn đảm bảo nguyên tắc thăng bằng electron nhưng các nguyên tố phải được viết ở dạng ion đúng, như NO3 , SO4 , MnO4 , Cr2O7 ,…
Nếu trong phản ứng oxi hóa khử có nhiều nguyên tố có số oxi hóa cùng tăng (hoặc cùng giảm) mà:
- Chúng thuộc một chất thì phải đảm bảo tỉ lệ số nguyên tử của các nguyên tố trong phân tử.
- Chúng thuộc các chất khác nhau thì phải đảm bảo tỉ lệ số mol của các chất đó theo đề cho.
Với hợp chất hữu cơ
Nếu hợp chất hữu cơ trước và sau phản ứng có một nhóm nguyên tử thay đổi và một số nhóm không đổi thì nên xác định số oxi hóa của C trong từng nhóm rồi cân bằng.
Nếu hợp chất hữu cơ thay đổi toàn phân tử, nên cân bằng theo số oxi hóa trung bình của C.
Ví dụ:
Fe + H2SO4 đặc nóng → Fe2(SO4)3 + SO2 + H2O
Fe0 → Fe+3 + 3e
1 x 2Fe0 → 2Fe+3 + 6e
3 x S+6 + 2e → S+4
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H20
Phương pháp cân bằng phản ứng cháy của chất hữu cơ
Phản ứng cháy của hidrocacbon:
Nên cân bằng theo trình tự sau:
- Cân bằng số nguyên tử H. Lấy số nguyên tử H của hidrocacbon chia cho 2, nếu kết quả lẻ thì nhân đôi phân tử hidrocacbon, nếu chẵn thì để nguyên.
- Cân bằng số nguyên tử C.
- Cân bằng số nguyên tử O.
Phản ứng cháy của hợp chất chứa O.
Cân bằng theo trình tự sau:
- Cân bằng số nguyên tử C.
- Cân bằng số nguyên tử H
Cân bằng số nguyên tử O bằng cách tính số nguyên tử O ở vế phải rồi trừ đi số nguyên tử O có trong hợp chất. Kết quả thu được đem chia đôi sẽ ra hệ số của phân tử O2 . Nếu hệ số đó lẻ thì nhân đôi cả 2 vế của PT để khử mẫu số.
Ví dụ. Cân bằng phản ứng:
FeS + HNO3 → Fe(NO3)3 + N2O + H2SO4 + H2O
Giải:
Fe+2 → Fe+3
S-2 → S+6
N+5 → N+1
Fe+2 → Fe+3 + 1e
S-2 → S+6 + 8e
FeS → Fe+3 + S+6 + 9e
2N+5 + 8e → 2N+1
→ Có 8FeS và 9N2O.
⇒8FeS + 42HNO3 → 8Fe(NO3)3 + 9N2O + 8H2SO4 + 13H2O
Các dạng bài tập ứng dụng cách cân bằng phản ứng oxi hóa khử thường gặp
Câu 1 Cân bằng phản ứng trong dung dịch bazơ:
NaCrO2 + Br2 + NaOH → Na2CrO4 + NaBr
Giải:
CrO2– + 4OH– → CrO42- + 2H2O + 3e
Br2 + 2e → 2Br–
Phương trình ion:
2CrO2– + 8OH– + 3Br2 → 2CrO42- + 6Br– + 4H2O
Phương trình phản ứng phân tử:
2NaCrO2 + 3Br2 + 8NaOH → 2Na2CrO4 + 6NaBr + 4H2O
Câu 2. Cân bằng phản ứng trong dung dịch có H2O tham gia:
KMnO4 + K2SO3 + H2O → MnO2 + K2SO4
Giải:
MnO4– + 3e + 2H2O → MnO2 + 4OH–
SO32- + H2O → SO42- + 2H+ + 2e
Phương trình ion:
2MnO4– + H2O + 3SO32- → 2MnO2 + 2OH– + 3SO42-
Phương trình phản ứng phân tử:
2KMnO4 + 3K2SO3 + H2O → 2MnO2 + 3K2SO4 + 2KOH
Câu 3. Cân bằng phản ứng oxi hóa – khử sau:
C6H12O6 + KMnO4 + H2SO4 → K2SO4 + MnSO4 + CO2 + H2O
Giải:
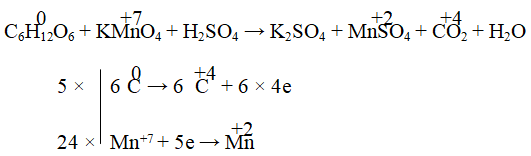
5C6H12O6 + 24KMnO4 + 36H2SO4 → 12K2SO4 + 24MnSO4 + 30CO2 + 66H2O
Câu 5. Cho phản ứng: Na2SO3 + KMnO4 + H2O → Na2SO4 + MnO2 + KOH
Tỉ lệ hệ số của chất khử và chất oxi hóa sau khi cân bằng là:
Giải:
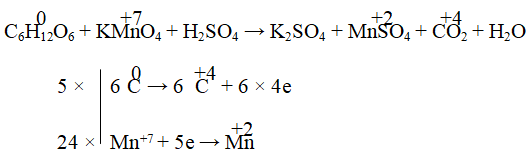
⇒ 3Na2SO3 + 2KMnO4 → 3Na2SO4 + 2MnO2
Kiểm tra hai vế: thêm 2KOH vào vế phải, thêm H2O vào vế trái.
⇒ 3Na2SO3 + 2KMnO4 + H2O → 3Na2SO4 + 2MnO2 + 2KOH
Mong rằng những nội dung trên đây sẽ giúp bạn trả lời được những thắc mắc câu hỏi của mình. Hơn hết đó là có thể giải được những bài toán của mình