Lý thuyết về sự điện li của nước, pH, Chất chỉ thị Axit – bazơ và bài tập có lời giải từ A – Z
Trong bài viết ngày hôm nay, THPT Chuyên Lam Sơn sẽ giúp các bạn học sinh giải đáp câu hỏi sự điện li của nước là gì? Kèm theo ví dụ có lời giải chi tiết trong bài viết dưới đây
Tham khảo thêm:
- Tính chất của phi kim và các dạng bài tập liên quan chuẩn 100%
- Tính chất hóa học của muối và các dạng bài tập liên quan chuẩn 100%
- Ancol là gì? Tính chất hóa học, công thức, cách điều chế ancol và các dạng bài tập
Nội Dung
Nước là chất điện li rất yếu
Sự điện li của nước
– Nước là chất điện li rất yếu. Thực nghiệm đã xác định được ở nhiệt độ thường cứ 555 triệu phân tử nước chỉ có 1 phân tử phân li ra ion.
– Phương trình điện li:
![]()
Tích số ion của nước
-Ở 25oC, tích số KH2O= [H+].[OH-] được gọi là tích số ion của nước. Tích số này là hằng số ở nhiệt độ xác định. Tuy nhiên, giá trị tích số ion của nước thường được dùng trong các phép tính, khi nhiệt độ không khác nhiều so với 25oC.
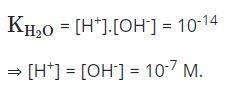
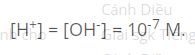
-Môi trường trung tính là môi trường trong đó:
Ý nghĩa tích số ion của nước
Môi trường axit là môi trường trong đó có: [H+] > [OH–] hay [H+] > 10-7 M.
Môi trường kiềm là môi trường trong đó có: [H+] < [OH–] hay [H+] < 10-7 M.
Kết luận: Độ axit và độ kiềm của dung dịch có thể đánh giá bằng nồng độ H+.
- Môi trường trung tính: [H+] = 10-7 M.
- Môi trường axit: [H+] > 10-7 M.
- Môi trường kiềm: [H+] < 10-7 M.
Khái niệm về pH. Chất chỉ thị axit – bazơ
Khái niệm về pH
pH được dùng để đánh giá độ axit và độ kiềm của dung dịch.

Về mặt toán học:
– Thang pH thường dùng có giá trị từ 1 đến 14, trong đó:
+ pH < 7: môi trường axit.
+ pH > 7: môi trường bazơ.
+ pH = 7: môi trường trung tính.
– Giá trị của pH có ý nghĩa to lớn trong thực tế. Chẳng hạn, pH của máu người và động vật có giá trị gần như không đổi hay tốc độ ăn mòn kim mòn kim loại trong nước tự nhiên phụ thuộc rất nhiều vào giá trị pH của nước.
Chất chỉ thị axit – bazơ
– Là chất có màu biến đổi phụ thuộc vào giá trị pH của dung dịch.
Ví dụ: Quỳ tím, phenolphatalenin.
Bảng màu của quỳ và phenolphtalein trong dung dịch ở các khoảng pH khác nhau.
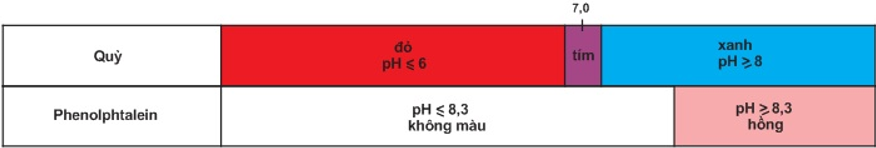
Trộn lẫn một số chất chỉ thị có màu biến đổi kế tiếp nhau theo giá trị pH, ta được hỗn hợp chất chỉ thị vạn năng. Dùng băng giấy tẩm dung dịch hỗn hợp này có thể xác định được gần đúng giá trị pH của dung dịch.
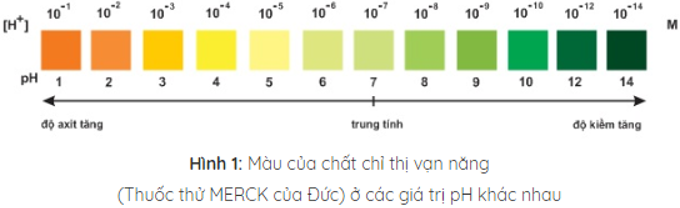
Bảng công thức pH trong các môi trường

Các dạng bài tập điện li của nước thường gặp
Câu 1: Cho 300 ml dung dịch chứa H2SO4 0,1M, HNO3 0,2M và HCl 0,3M tác dụng với V ml dung dịch NaOH 0,2 M và KOH 0,29M thu được dung dịch có pH = 2. Giá trị của V là
Giải?
Coi 300 ml dung dịch A gồm 100 ml H2SO4 0,1M 100 ml HNO3 0,2M và 100 ml HCl 0,3M trộn lại với nhau. Vậy:
Phản ứng của dung dịch A và B là: H+ + OH– → H2O
nH+ p/ư = nOH– = 0,049.0,001V ⇒ nH+ p/ư = 0,01 (0,3 + 0,001V)
⇒ 0,07 = 0,49.0,001V + 0,010,3 + 0,001V) ⇒ V = 134 ml
Câu 2: Trộn 200 ml dung dịch gồm HCl 0,1M vá H2SO4 0,15M với 300 ml dung dịch
Giải:
Sau phản ứng trung hòa pH = 1 ⇒ H+ dư
H+ + OH– → H2O
nH+bd = 0,08 mol; sau phản ứng pH = 1
⇒ nH+ sau p/ư = 0,05 mol
nH+p/ư = nOH– = 0,03 mol
⇒ nBa(OH)2 = 0,015 mol
⇒ CM Ba(HCO3)2 = 0,05 (mol/l)
nBaSO4 = nBa(OH)2 = 0,015 mol (H2SO4 dư) ⇒ mBaSO4 = 3,495g
Câu 3: Dung dịch A có chứa 5 ion :Mg2+ ,Ba2+ ,Ca2+ và 0,1 mol Cl– và 0,2 mol NO3 . Thêm dần V ml dung dịch K2CO3 1M vào dung dịch A đến khi thu được lượng kết tủa lớn nhất. V có giá trị là
Giải:
Khi thêm K2CO3 vào dung dịch A, khi lượng kết tủa thu được là lớn nhất tức là toàn bộ Mg2+, Ba2+, Ca2+ đã kết tủa, trong dung dịch còn lại KCl và KNO3
⇒ nK+ = nCl– + nNO3– = 0,3 mol
⇒ nK2CO3 = 0,15 mol
⇒ VK2CO3 = 150 ml
Câu 4: Cho 10 ml dung dịch X chứa HCl 1M và H2SO4 0,5M. thể tích dung dịch NaOH 1M cần đẻ trung hòa dung dịch X là
Giải:
H+ + OH– → H2O
Ta có: ⇒ V = 20 ml.
Câu 5: Viết phương trình phân tử và ion rút gọn của các phản ứng sau (nếu có) xảy ra trong dung dịch:
a) KNO3 + NaCl b) NaOH + HNO3
c) Mg(OH)2 + HCl d) Fe2(SO4)3 + KOH
e) FeS + HCl f) NaHCO3 + HCl
g) NaHCO3 + NaOH h) K2CO3 + NaCl
i) CuSO4 + Na2S
Giải:
a. Không xảy ra
b. NaOH + HNO3 → NaNO3 + H2O
H+ + OH– → H2O
c. Mg(OH)2 + 2HCl → MgCl2 + H2O
Mg(OH)2 + 2H+ → Mg2+ + H2O
d. Fe2(SO4)3 + 6KOH → 2Fe(OH)3↓ + 3K2SO4
Fe3+ + 3OH– → Fe(OH)3↓
e. FeS + 2HCl → FeCl2 + H2S↑
FeS + 2H+ → Fe2+ + H2S↑
f. NaHCO3 + HCl → NaCl + CO2↑ + H2O
HCO3– + H+ → CO2↑ + H2O
g. NaHCO3 + NaOH → Na2CO3 + H2O
HCO3– + OH– → CO32- + H2O
h. Không xảy ra
i. CuSO4 + Na2S → CuS↓ + Na2SO4
Cu2+ + S2- → CuS↓
Bài 6: Dd X chứa các ion: Fe3+, SO42-, NH4+, Cl–. Chia dd X thành hai phần bằng nhau:
Phần 1: tác dụng với lượng dư dd NaOH, đun nóng thu được 0,672 lít khí (đktc) và 1,07 gam kết tủa.
Phần 2: tác dụng với lượng dư dd BaCl2, thu được 4,66 gam kết tủa. Tổng khối lượng các muối khan thu được khi cô cạn dd X là (quá trình cô cạn chỉ có nước bay hơi)
Giải:
nNH4+ = nNH3 = 0,672/22,4 = 0,03 mol
nFe3+ = 1,07/107 = 0,01 mol; nSO42- = 4,66/233 = 0,02 mol
Áp dụng đL bảo toàn điện tích: 3.0,01 + 0,03 = 2.0,02 +x ⇒ x = 0,02
m = 0,01.56 + 0,03.18 + 0,02.96 + 0,02.35,5 = 3,73 gam
Khối lượng muối khan trong dung dịch X: 3,73.2 = 7,46 gam
Mong rằng những nội dung trên đây sẽ giúp bạn trả lời được những thắc mắc câu hỏi của mình. Hơn hết đó là có thể giải được những bài toán của mình