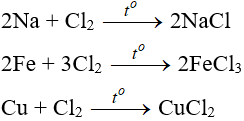Phương trịnh điện li là gì? Cách viết phương trình điện li kèm theo VD minh họa
Phương trình điện li là một trong những chuyên đề khá quan trọng trong chương trình hóa học lớp 11. Việc hiểu các định nghĩa về sự điện li cũng như một số phương trình điện li cơ bản luôn là điều cần thiết và bắt buộc trước khi giải một bài tập hóa học. Ở bài viết này chúng tôi sẽ làm rõ cho các bạn tất tần tật lý thuyết về chương này cũng như những bài tập hóa học quan trọng.
Tham khảo thêm:
- Dãy hoạt động hóa học của kim loại và các dạng bài tập liên quan có lời giải chi tiết từ A – Z
- Tỉ khối của chất khí là gì? Công thức tỉ khối của chất khí và bài tập có lời giải chi tiết từ A- Z
- Cách cân bằng phương trình hóa học oxi hóa khử và các dạng bài tập có lời giải chi tiết từ A- Z
Nội Dung
Phương trình điện li là gì?
-Sự điện li là sự phân li thành ion dương và ion âm của phân tử chất đện li khi tan trong nước.
– Chất không điện li khi tan trong nước tạo thành dung dịch không dẫn điện.
– Sự điện li có thể minh họa thành một phương trình phản ứng gọi là phương trình điện li hay phương trình ion hóa
Nguyên tắc khi viết phương trình điện li
Chất điện li mạnh
Chất điện li yếu là chất mà khi tan trong nước, các phân tử hòa tan đều phân li ra ion. Chúng ta cùng tìm hiểu một số phương trình điện li của các chất điện li mạnh đặc trưng dưới đây:
+) Axit: HCl, H2SO4 , HNO3 …
- HCl → H+ + Cl-
- H2SO4 → 2H+ + SO4
+) Bazo: NaOH, Ca(OH)2 …
- NaOH → Na+ + OH-
- Ca(OH)2 → Ca2+ + 2OH-
+) Muối: NaCl, CaCl2 , Al2(SO4)3
- NaCl → Na+ + Cl-
- CaCl2 → Ca2+ + 2Cl-
- Al2(SO4)3 → 2Al3+ + 3SO4
Chất điện li yếu
Ngược lại với chất điện li mạnh thì chất điện li yếu là chất mà khi chúng được hòa tan trong nước, sẽ có một số ít phần từ hòa tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phần tử trong dung dịch.Các chất điện li yếu thường gặp là: axit yếu, bazo yếu, các muối không tan, muối dễ bị phân hủy,..
Ví dụ: HF, H2S, H2SO3,CH3COOH, NH3, Fe(OH)2, Cu(OH)2, AgCl, PbSO4… Và đặc biệt H2O là một chất điện li yếu.
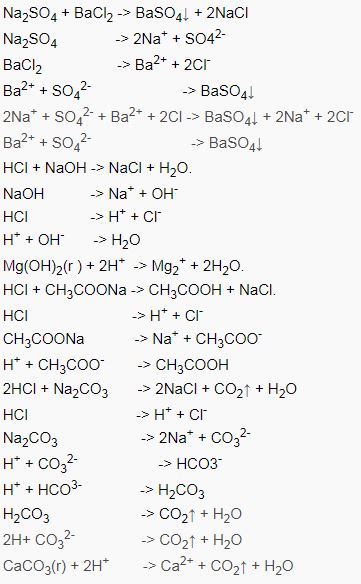
Tổng hợp phương trình điện li thường gặp
Ngoài việc nắm vững kĩ năng và định nghĩa ở phần trên, thì kiến thức một số phương trình điện li thường gặp cũng khá quan trọng, giúp các bạn đỡ được nhầm lẫn. Cùng tìm hiểu qua một số chất sau đây nhé !
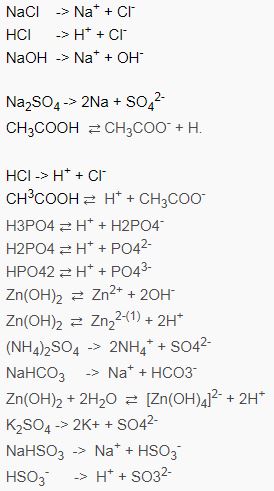
Phương pháp giải phương trình điện li
Dạng 1: Chất điện li mạnh
Bước 1: Viết phương trình điện li của chất điện li mạnh
- Dựa vào bảng phương trình trên cùng với dữ kiện đề bài, ta thiết lập một số phương trình liên quan đến các chất có trong đề bài. Một trong những chất điện li mà chúng ta khá hay quên đó chính là H2O. Đây là bước cực kì quan trọng quyết định trực tiếp đến kết quả tính toán của bài tập.
Bước 2: Xác định nồng độ mol của ion
- Tính số mol của chất điện li có trong dung dịch
- Viết phương trình điện li chính xác, biểu diễn số mol lên các phương trình điện li đã biết
- Tính nồng độ mol của ion
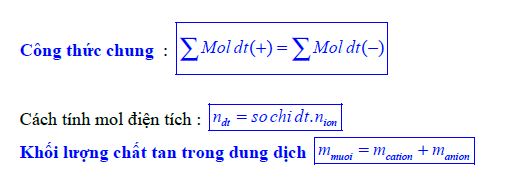
Dạng 2: Định luật bảo toàn điện tích
Bước 1: Phát biểu định luật
Trong một dung dịch chứa hoàn toàn các chất điện li, thì tổng số mol của điện tích âm luôn bằng tổng số mol của điện tích dương. (Luôn luôn bằng nhau)
Dạng 3: Bài toán về chất điện li
Bước 1: Viết phương trình điện li
Như chúng ta đã tìm hiểu cách viết phương trình điện li rất chi tiết ở phía trên. Ở đây chúng ta không cần nêu lại nữa mà tiến hành sang bước 2 đó là …
Bước 2: xác định độ điện li
Áp dụng công thức độ điện li dưới đây nhé:

Sau đó xử dụng phương pháp 3 dòng thật hiệu quả:
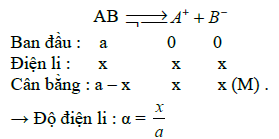
Biến số anla có thể quyết định nó là chất điện li mạnh, yếu hay là chất không điện li. Cụ thể là:
- α = 1 : chất điện li mạnh
- 0 < α < 1 : chất điện li yếu
- α = 0 : chất không điện li
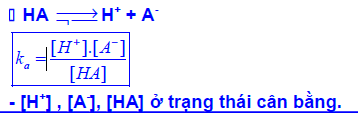
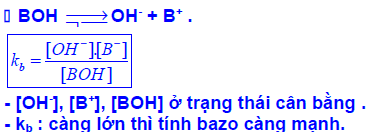
Dạng 4: Xác định hằng số điện li
Để làm bài toán này ta chia thành các bước như sau: Xác định hằng số của axit và xác định hằng số điện li của bazơ
Dạng 5: Tính độ PH dựa vào nồng độ H+
Bước 1: Tính độ Ph của Axit
- Tính số mol axit điện li axit
- Viết phương trình điện li axit
- Tính nồng độ mol H+ sau đó suy ra nồng độ mol của PH bằng mối liên hệ giữa hai nồng độ này qua hàm log.
![]()
Bước 2: Xác định độ PH của bazo
Ta thực hiện theo các bước sau:
- Tính số mol bazo của điện li
- Viết phương trình điện li bazo
- Tính nồng độ mol OH- rồi suy ra [H]+
- Tính độ PH
Dạng 6: Xác định nồng độ mol dựa vào độ pH
Bài toán trải qua hai quá trình tính nồng độ mol của axit và nồng độ mol của bazo. Và lưu ý một số điểm như sau:
- pH > 7 : môi trường bazo .
- pH < 7 : môi trường axit .
- Ph = 7 : môi trường trung tính .
Dạng 7: Axit, bazo và sự lưỡng tính theo hai lý thuyết
Đây là một dạng toán khá ít gặp tuy nhiên các em cần nắm vững hai lý thuyết A – rê – ni – ut về sự điện li và thuyết Bron – stêt về thuyết proton. Hai thuyết này có sự định nghĩa hoàn toàn khác nhau về thế nào là chất bazơ và thế nào là chất axit.
Các dạng bài tập phương trình điên li thường găp
Ví dụ 1: Trong các phản ứng dưới đây, ở phản ứng nào nước đóng vai trò là một axit, ở phản ứng nào nước đóng vai trò là một bazo (theo Bron – stêt).
1. HCl + H2O → H3O+ + Cl-
2. CuSO4 + 5H2O → CuSO4.5H2O .
Giải:
1. HCl → H+ + Cl-
H2O + H+ → H3O+
Do đó H2O nhận proton H+ nên thể hiện tính bazo .
2. NH3 + H+OH → NH4+
Do đó H2O nhường proton H+ nên thể hiện tính axit.
Ví dụ 2: Cần bao nhiêu gam NaOH để pha chế 300 ml dung dịch có pH = 10.
Giải:
pH = 10 → [H+] = 10^ -10.
Ta có : [H+].[OH-] = 10^ -14 → [OH-] = 10^ -4 (M) → nOH- = 3.10^-5 (mol) .
NaOH → Na+ + OH- .
3.10^-5 3.10-5 (mol)
Từ đó suy ra: mNaOH = = 1,2.10-3 (g).
Ví dụ 3: Tính pH của dung dịch chứa 1,46 gam HCl trong 400 ml .
Giải:
nHCl = 0,04 (mol)
HCl → H+ + Cl-
0,04 0,04 (mol) .
[H+] = 0,04/0,4 = 0,1 (M).
pH = – lg[H+] = 1.
Ví dụ 4: Tính pH của dung dịch chứa 0,4 gam NaOH trong 100 ml .
Giải:
nNaOH = 0,4/40 = 0,01 (mol) .
NaOH → Na+ + OH- .
0,01 0,01 (mol) .
[OH-] = 0,01/0,1 = 0,1 (M) .
Ta có : [H+].[OH-] = 10-14 → [H+] = 10-13 → pH = 13 .
Ví dụ 5: Dung dịch A chứa Na+ 0,1 mol , Mg2+ 0,05 mol , SO4 2- và 0,04 mol còn lại là Cl- . Tính khối lượng muối
trong dung dịch.
Giải:
Vẫn áp dụng các công thức trên về cân bằng điện tích ta dễ dàng tính được khối lượng muối trong dung dịch là: m = 11.6 gam.
Ví dụ 6: Hòa tan 12,5 gam tinh thể CuSO4.5H2O trong nước thành 200 ml dung dịch . Tính nồng độ mol các ion trong dung dịch thu được .
Giải:
nCuSO4. 5H2O = 12,5/250 = 0,05 (mol)
CuSO4.5H2O → Cu2+ + SO4 2- + 5H2O
0,05 0,05 0,05 (mol)
[ Cu2+] = [SO42-] = 0.05/0.2 = 0.25M
Vậy là qua rất nhiều bài tập cũng như ví dụ, chúng ta đã tìm hiểu cách viết phương trình điện li cũng như một số bài tập cực hay liên quan đến chuyên đề này. Còn thắc mắc gì nữa về chương trình hóa học 11 nói chung cũng như chương điện li 3 nói riêng thì các em có thể để lại bình luận xuống bên dưới bài viết này. Chúc các em học tốt.