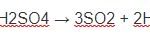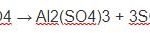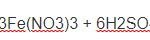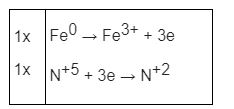Lý thuyết Fe + H2SO4 → FeSO4+ H2 và bài tập có đáp án
Fe + H2SO4 → FeSO4+ H2 được THPT Chuyên Lam Sơn biên soạn hướng dẫn các bạn học sinh viết và cân bằng phương trình phản ứng Fe tác dụng với H2SO4 loãng, sau phản ứng sản phẩm sinh ra sau phản ứng khí H2 và muối sắt II.
Tham khảo thêm:
Nội Dung
Phương trình phản ứng Fe tác dụng với H2SO4 loãng:
Fe + H2SO4 → FeSO4 + H2
Điều kiện phản ứng xảy ra Fe tác dụng với H2SO4 loãng: Nhiệt độ thường, H2SO4 loãng
Cách thực hiện phản ứng ra Fe tác dụng với H2SO4 loãng: Cho sắt tác dụng với dung dịch axit sunfuric loãng thu được muối sắt(II)sunfat
Hiện tượng nhận biết phản ứng ra Fe tác dụng với H2SO4 loãng: Kim loại tan dần tạo thành dung dịch màu xanh nhạt đồng thời xuất hiện bọt khí thoát ra.
Tính chất hóa học của Fe
Tác dụng với phi kim
+) Với oxi: 3Fe + 2O2 Fe3O4
+) Với clo: 2Fe + 3Cl2 2FeCl3
+) Với lưu huỳnh: Fe + S FeS
Ở nhiệt độ cao, sắt phản ứng được với nhiều phi kim.
Tác dụng với dung dịch axit
+) Tác dụng với với HCl, H2SO4 loãng
Fe + 2HCl → FeCl2 + H2
+) Tác dụng với H2SO4 đặc, nóng; HNO3 đặc:
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 4HNO3 → Fe(NO3)3 + NO↑ + 2H2O
Fe + 6HNO3 → Fe(NO3)3+ 3NO2↑ + 3H2O
Không tác dụng với H2SO4 đặc nguội, HNO3 đặc, nguội
Tác dụng với dung dịch muối
+) Sắt đẩy kim loại yếu hơn ra khỏi dung dịch muối tạo thành muối sắt tương ứng và giải phóng kim loại mới.
Fe + Cu(NO3)2 → Fe (NO3)2 + Cu
Fe + CuSO4 → FeSO4 + Cu
Bài tập phản ứng Fe + H2SO4
Câu 1. Nhận xét nào sau đây không đúng?
A. Crom là kim loại cứng nhất trong tất cả các kim loại
B. Nhôm và crom đều phản ứng với HCl theo cùng tỉ lệ số mol.
C. Vật dụng làm bằng nhôm và crom đều bền trong không khí và nước vì có màng oxit bảo vệ.
D. Sắt và nhôm đều bị thụ động hóa bởi HNO3 đặc, nguội
Giải:
Nhận xét không đúng là
Nhôm và crom đều phản ứng với HCl theo cùng tỉ lệ số mol.
Phương trình hóa học minh họa
2Al + 6HCl → 2AlCl3 + 3H2;
Cr + 2HCl → CrCl2 + H2
Câu 2. Nội dung nhận định nào sau đây không đúng
A. Kim loại có độ cứng cao nhất trong các kim loại là Crom
B. Các kim loại Al, Fe, Cr bị thụ động hóa trong dung dịch HNO3 đặc nguội và H2SO4 đặc
nguội
C. Kim loại kiềm được điều chế bằng phương pháp điện phân dung dịch muối halogenua của nó
D. Lưu huỳnh là chất có tính oxi hóa yếu, Hg có thể tác dụng lưu huỳnh ngay ở nhiệt độ thường. Với các kim loại khác cần có xúc tác hoặc nhiệt độ.
Giải:
C sai: Các kim loại kiềm và kiềm thổ được điều chế bằng phương pháp điện phân nóng chảy muối halogen.
A. Kim loại có độ cứng cao nhất trong các kim loại là Crom => đúng
B. Các kim loại Al, Fe, Cr bị thụ động hóa trong dung dịch HNO3 đặc nguội và H2SO4 đặc
nguội => đúng
D. Lưu huỳnh là chất có tính oxi hóa yếu, Hg có thể tác dụng lưu huỳnh ngay ở nhiệt độ thường. Với các kim loại khác cần có xúc tác hoặc nhiệt độ => đúng
Câu 3. Để nhận biết sự có mặt của Fe trong hỗn hợp gồm Fe và Ag có thể dùng dung dịch nào
Giải:
Để nhận biết sự có mặt của Fe trong hỗn hợp gồm Fe và Ag có thể dùng dung dịch:
C. H2SO4 đặc, nguội vì Fe bị thụ động trong dung dịch H2SO4 đặc nguội còn Ag thì phản ứng được với H2SO4 đặc nguội
Phương trình hóa học minh họa
2Ag + 2H2SO4→ Ag2SO4 + SO2 + 2H2O
Câu 4. Cho 5,6 gam Fe vào 200 ml dung dịch Cu(NO3)2 1M và HCl 2M thu được khí NO và m gam kết tủa. Xác định m. Biết rằng NO là sản phẩm khử duy nhất của NO3– và không có khí H2 bay ra.
Giải:
Fe sẽ phản ứng với H+ và NO3– trước
3Fe + 8H+ + 2NO3– → 3Fe2+ + 2NO + 4H2O.
0,15 ← 0,4 mol
nFe = 0,2 mol ; nH+ = 0,4 mol ; nNO3– = 0,4 mol ; nCu2+ = 0,2 mol
( do 8nFe / 3 > nH+ => chỉ tạo muối Fe2+ )
=> Fe dư 0,05 mol
Fe + Cu2+ → Cu + Fe2+
0,05 → 0,05
=> m↓ = 0,05 . 64 = 3,2 g
Câu 5. Cho 12 gam hỗn hợp hai kim loại Fe, Cu tác dụng vừa đủ với dung dịch HNO3 63%. Sau phản ứng thu được dung dịch A và 11,2 lít khí NO2 duy nhất (đktc). Nồng độ % các chất có trong dung dịch A là :
Giải:
Phương trình phản ứng hóa học xảy ra:
Fe + 6HNO3 → Fe(NO3)3 + 3NO2 + 3H2O
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
nNO2 = 0,5 mol => nHNO3 = 2nNO2 = 1 (mol)
Áp dụng định luật bảo toàn khối lượng ta có:
mhh muối = mhh kim loại + m dd HNO3 – mNO2 = 12 + 1.63.100/63 – 46.0,5 = 89 (gam)
Gọi số mol của Fe, Cu lần lượt là a, b mol
Ta có hệ phương trình như sau:
56a + 64b = 12 (1)
3a + 2b = 0,5 (2)
Giải hệ phương trình (1) , (2) ta có => a = 0,1 ; b = 0,1
mFe(NO3)3 = 0,1.(56 + 62.3) = 24,2 (gam)
mCu(NO3)2= 0,1.(64 + 62.2) = 18,8 (gam)
% mFe(NO3)3 = 24,2/89.100% = 27,19%
% mCu(NO3)2 = 18,8/89.100% = 21,1%
Câu 6. Hòa tan hoàn toàn 20 gam hỗn hợp Mg và Fe trong dung dịch HCl 4M thu được 11,2 lít H2 (đktc) và dung dịch X. Để kết tủa hoàn toàn các ion trong X cần 600 ml dung dịch NaOH 2M. Thể tích dung dịch HCl đã dùng là:
Giải:
Áp dụng định luật bảo toàn nguyên tố Natri
nNaCl = nNaOH = 1,2(mol)
Áp dụng định luật bảo toàn nguyên tố Clo
=> nHCl = nNaCl = 1,2 (mol)
VHCl = 1,2 : 4 = 0,3 lít
Sau khi đọc xong bài viết của chúng tôi bạn có thể biết được Fe + H2SO4 để vận dụng vào làm các bài tập từ cơ bản đến nâng cao nhanh chóng nhé