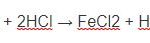Lý thuyết Fe + 2HCl → FeCl2 + H2 và bài tập có đáp án
Fe + 2HCl → FeCl2 + H2 thuộc loại phản ứng oxi hóa khử. Để biết phương trình đã được cân bằng chính xác chưa, vì vậy THPT Chuyên Lam Sơn sẽ phân tích Fe ra FeCl2 chi tiết trong bài viết dưới đây
Tham khảo thêm:
- C2H5OH + CuO → CH3CHO + Cu + H2O: Lý thuyết và bài tập có đáp án
- C6H12O6 → 2C2H5OH + 2CO2: Lý thuyết và bài tập có đáp án
- CH3COOH + NaOH → CH3COONa + H2O: Lý thuyết và bài tập có đáp án
Nội Dung
Phương trình Fe ra FeCl2:
Fe + 2HCl → FeCl2 + H2
Điều kiện phản ứng Sắt tác dụng với axit clohidric: Nhiệt độ thường
Cách thực hiện phản ứng Fe tác dụng với HCl: Cho một ít kim loại Fe vào đáy ống nghiệm, nhỏ 1 – 2 ml dung dịch axit HCl vào ống nghiệm đã bỏ sẵn mẩu Fe.
Hiện tượng sau phản ứng Fe tác dụng với HCl: Kim loại tan dần tạo thành dung dịch màu xanh nhạt đồng thời xuất hiện bọt khí thoát ra.
Chú ý: Kim loại Fe phản ứng với các axit không có tính oxi hóa như HCl; H2SO4 loãng thì chỉ tạo muối sắt (II). Còn khi cho Fe tác dụng với các axit có tính oxi hóa mạnh thì Fe sẽ bị oxi hóa lên Fe+3.
Thông tin mở rộng tính chất hóa học của Fe
Tác dụng với phi kim
Với oxi: 3Fe + 2O2 → Fe3O4
Với clo: 2Fe + 3Cl2 → 2FeCl3
Với lưu huỳnh: Fe + S → FeS
Ở nhiệt độ cao, sắt phản ứng được với nhiều phi kim.
Tác dụng với dung dịch axit
+) Tác dụng với với HCl, H2SO4 loãng
Fe + 2HCl → FeCl2 + H2
+) Tác dụng với H2SO4 đặc, nóng; HNO3 đặc:
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
Không tác dụng với H2SO4 đặc nguội, HNO3 đặc, nguội
Tác dụng với dung dịch muối
Đẩy được kim loại yếu hơn ra khỏi muối
Fe + CuSO4 → FeSO4 + Cu
Bài tập phản ứng Fe ra FeCl2
Câu 1. Cho 8,85 gam hỗn hợp X gồm Al, Mg tác dụng với dung dịch HCl dư, thu được 8,96 lít H2 (đktc). Thành phần phần trăm khối lượng của Al trong X là
Giải:
nH2 = 0,3 mol
Bảo toàn electron
3nAl + 2nMg = 2nH2 ⇒ 3nAl + 2nMg = 0,85 (1)
mhh = 27nAl + 24nMg = 8,85 (2)
Giải hệ (1) và (2) ⇒ nAl = 0,15 (mol); nMg = 0,2 mol
⇒ %mAl = 0,15.27/8,85 .100% = 45,76%
Câu 2. Hòa tan 10 gam hỗn hợp bột Fe và Fe2O3 bằng một lượng dung dịch HCl vừa đủ, thu được 1,12 lít hidro (đktc) và dd X. Cho dd X tác dụng với dd NaOH lấy dư. Lấy kết tủa thu được đem nung nóng trong không khí đến khối lượng không đổi thu được chất rắn Y. Khối lượng chất rắn Y là:
Giải:
nH2(đktc) = 1,12: 22,4 = 0,05 (mol)
Phương trình hóa học:
Fe + 2HCl → FeCl2 + H2↑ (1)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O (2)
Theo phương trình hóa học (1): nFe = nH2 = 0,05 (mol) → mFe = 0,05×56 = 2,8 (g)
→ mFe2O3 = mhh – mFe = 10 – 2,8 =7,2 (g) → nFe2O3 = 7,2 : 160 = 0,045 (mol)
Theo phương trình hóa học (1): nFeCl2 = nFe = 0,05 (mol)
Theo phương trình hóa học (2): nFeCl3 = 2nFe2O3 = 2.0,05 = 0,1 (mol)
dung dịch X thu được chứa: FeCl2: 0,05 (mol) và FeCl3: 0,1 (mol)
FeCl2 + 2NaOH → Fe(OH)2 + NaCl
FeCl3 + 3NaOH → Fe(OH)3 + NaCl
Kết tủa thu được Fe(OH)2 và Fe(OH)3
Nung 2 kết tủa này thu được Fe2O3
BTNT “Fe”: 2nFe2O3 = nFeCl2 + nFeCl3 → nFe2O3 = (0,05 + 0,1)/2 = 0,075 (mol)
→ mFe2O3 = 0,075 × 160 = 12 (g)
Câu 3. Có 4 kim loại X, Y, Z, T đứng sau Mg trong dãy hoạt động hoá học. Biết rằng:
X và Y tác dụng với dung dịch HCl giải phóng khí hidro.
Z và T không phản ứng với dung dịch HCl.
Y tác dụng với dung dịch muối của X và giải phóng X.
T tác dụng được với dung dịch muối của Z và giải phóng Z.
Hãy xác định thứ tự sắp xếp nào sau đây là đúng (theo chiều hoạt động hóa học giảm dần)
Giải:
X, Y phản ứng được với HCl => X, Y đứng trước H trong dãy hoạt động hóa học
Z, T không phản ứng với HCl => Z, T đứng sau H trong dãy hoạt động hóa học
=> X, Y có tính khử mạnh hơn Z, T. Giờ chỉ so sánh Z và T
T đẩy được Z ra khỏi muối của Z => T có tính khử mạnh hơn Z
=> Z là có tính khử yếu nhất
Câu 4. Khi điều chế FeCl2 bằng cách cho Fe tác dụng với dung dịch HCl. Để bảo quản dung dịch FeCl2 thu được không bị chuyển thành hợp chất sắt (III), người ta có thể cho thêm vào dung dịch
Giải:
Dung dịch FeCl2 dễ bị không khí oxi hóa thành muối Fe3+. Để bảo quản FeCl2 người ta thêm 1 lương Fe vì: Fe + 2Fe3+ → 3Fe2+
Không dùng HNO3 vì HNO3 oxi hóa luôn ion Fe2+ thành Fe3+,
Không dùng Zn sẽ tạo ra 1 lượng muối Zn2+,
Câu 5. Khử m gam Fe3O4 bằng khí H2 thu được hổn hợp X gồm Fe và FeO, hỗn hợp X tác dụng vừa hết với 1,5 lít dung dịch H2SO4 0,2M (loãng). Giá trị của m là
Giải:
Theo bài ra, xác định được sau phản ứng chỉ thu được FeSO4
→ nFeSO4 = nSO42- = naxit = 0,3 mol.
Bảo toàn nguyên tố Fe → nFe3O4 = 0,3 : 3 = 0,1 mol
→ m = 0,1.232 = 23,2 gam.
Trong bài viết này, chúng tôi chưa đủ dữ liệu để nói về phản ứng Fe ra FeCl2 nên chúng tôi luôn ghi nhận đóng góp thông tin từ quý đọc giả.