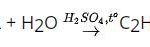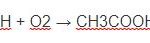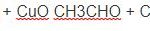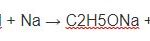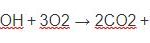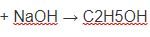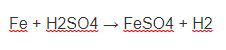Lý thuyết C2H5OH → C2H4 + H2O và bài tập có đáp án
C2H5OH → C2H4 + H2O là phương trình phản ứng từ C2H5OH ra C2H4 ở nhiệt độ thích hợp mà THPT Chuyên Lam Sơn đã tổng hợp chi tiết dưới đây giúp các bạn có thể ứng dụng vào giải các dạng câu hỏi bài tập liên quan đến điều chế etilen trong phòng thí nghiệm
Tham khảo thêm:
- Lý thuyết và cách xác định số oxi hóa của các nguyên tố kèm VD đầy đủ nhất
- Phương trịnh điện li là gì? Cách viết phương trình điện li kèm theo VD minh họa
- Dãy hoạt động hóa học của kim loại và các dạng bài tập liên quan có lời giải chi tiết từ A – Z
Nội Dung
Phản ứng điều chế C2H5OH ra C2H4
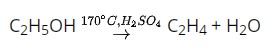
Điều kiện phản ứng điều chế C2H5OH ra C2H4 :
- Nhiệt độ: 170°C
- Xúc tác: H2SO4
Điều chế etilen trong phòng thí nghiệm
Hóa chất và dụng cụ
H2SO4đặc, rượu etylic (C2H5OH), Canxi cacbua (CaC2), Pd, đá bọt ….
Đèn cồn, ống nghiệm, giá đỡ, kẹp, chậu thủy tinh, ống dẫn khí,…
Phương pháp thu khí etilen
- Cách 1: Sử dụng phương pháp đẩy nước, do khí etilen là chất khí ít tan trong nước.
- Cách 2: Điều chế khí axetilen từ canxi cacbua, sau đó cho tác dụng với khí Hidro có xúc tác Pd hoặc Pb.
Phương trình hóa học
Cách 1: Sử dụng phương pháp đẩy nước, do khí etilen là chất khí ít tan trong nước.
C2H5OH → C2H4 + H2O (Xúc tác của H2SO4 đặc, nhiệt độ 170 độ C)
Cách 2: Điều chế khí axetilen từ canxi cacbua, sau đó cho tác dụng với khí Hidro có xúc tác Pd hoặc Pb.
CaC2 + 2H2O → C2H2 + Ca(OH)2
C2H2 + H2→ C2H4 (Xúc tác Pd hoặc Pb)
Tính chất của rượu etylic
Tính chất vật lí của rượu etylic
Rượu etylic là chất lỏng không màu, sôi ở 78,3oC
Nhẹ hơn nước và tan vô hạn trong nước. Rượu etylic hòa tan được nhiều chất như iot, benzen,…
Độ rượu và cách tính độ rượu
Độ rượu là số ml rượu etylic nguyên chất có trong 100 ml hỗn hợp rượu etylic với nước.
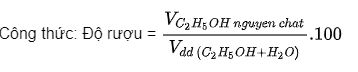
V là thể tích đo bằng ml hoặc lít
Tính chất hóa học của rượu etylic
Phản ứng cháy
Rượu etylic cháy với ngọn lửa màu xanh, tỏa nhiều nhiệt
C2H5OH + 3O2 → 2CO2 + 3H2O
Tác dụng với kim loại mạnh như K, Na
Thả mẩu natri vào cốc đựng rượu etylic, mẩu natri tan dần và có bọt khí thoát ra
2C2H5OH + Na → 2C2H5ONa + H2↑
Phản ứng với axit axetic
Đổ rượu etylic vào cốc đựng axit axetic với xúc tác H2SO4 đặc, tạo thành dung dịch đồng nhất. Đun nóng hỗn hợp một thời gian, trong ống nghiệm xuất hiện chất lỏng không màu, mùi thơm, không tan trong nước, nổi trên mặt nước.
![]()
etylic axit axetic etylaxetat
Bài tập phản ứng C2H5OH ra C2H4
Câu 1. Ancol etylic được điều chế từ tinh bột bằng phương pháp lên men với hiệu suất toàn bộ quá trình là 90%, Hấp thụ toàn bộ lượng CO2, sinh ra khi lên men m gam tinh bột vào nước vôi trong, thu được 335 gam kết tủa và dung dịch A. Biết khối lượng A giảm đi so với khối lượng nước vôi trong ban đầu là 137 gam. Giá trị của m là:
Giải:
C6H10O5 → C6H12O6 → 2C2H5OH + 2CO2
m dd giảm = mCaCO3 – mCO2
=> mCO2 = mCaCO3 – mdd giảm = 335 – 137 = 198 gam
=> nCO2 = 198 : 44 = 4,5 mol
=> m = 4,5:2.162.100/90 = 405 gam
Câu 2. Điều chế etilen trong phòng thí nghiệm từ C2H5OH, (H2SO4 đặc, 170oC) thường lẫn các oxit như SO2, CO2. Chất dùng để làm sạch etilen là
Giải:
Ta dùng NaOH dư sẽ loại bỏ được CO2, SO2 mà không ảnh hưởng đến sản phẩm cần điều chế.
SO2 + 2NaOH dư → Na2SO3 + H2O
CO2 + 2NaOH → Na2CO3 + H2O
Ta không dùng KMnO4 và Brom vì nó phản ứng với sản phẩm chính CH2=CH2 và SO2
Na2CO3 thì không phản ứng với SO2
Câu 3. Có 3 lọ mất nhãn chứa 3 chất lỏng: rượu etylic, axit axetic, etyl axetat bằng cách nào sau đây để có thể nhận biết 3 dung dịch trên?
Giải:
Dùng dung dịch Na2CO3 để nhận biết.
Cho dung dịch Na2CO3 vào 3 dung dịch, lọ đựng dung dịch axit axetic sủi bọt khí, lọ tạo dung dịch phân lớp là etyl axetat, lọ không hiện tượng là rượu etylic.
Câu 4. Khi đun nóng hỗn hợp gồm C2H5OH và C3H7OH với H2SO4 đặc ở 140oC có thể thu được số ete tối đa là
Giải:
Đề hỏi số anken tối đa => Xét trường hợp C3H7OH có 2 đồng phân
=> Khi đun hỗn hợp 3 ancol (C2H5OH và C3H7OH) tạo (3.4)/2= 6 ete
Câu 5. Hiện tượng quan sát được khi sục khí etilen lần lượt vào ống nghiệm thứ (1) chứa dung dịch KMnO4; ống thứ (2) chứa dung dịch AgNO3 là:
Giải:
Ống nghiệm 1 thuốc tím mất màu, kết tủa nâu tạo thành là MnO2.
3C2H4 + 2KMnO4 + 4H2O → 3C2H4(OH)2+ 2MnO2 + 2KOH
Ống nghiệm 2 không phản ứng.
Câu 6. Đốt cháy hoàn toàn m gam hỗn hợp 3 ancol đơn chức, thuộc cùng dãy đồng đẳng, thu được 7,612 lít khí CO2 (đktc) và 10,8 gam H2O. Giá trị của m là
Ta có: nCO2 = 0,34 mol; nH2O = 0,6 mol
Ta thấy: nH2O > nCO2 => 3 ancol là no, đơn chức, mạch hở
=> nancol = nH2O – nCO2 = 0,6 – 0,34 = 0,26 mol
Đặt công thức chung của 3 ancol là CnH2n+2O
Ta có: nO(ancol)= nancol= 0,26 mol; nC(ancol) = nCO2 = 0,34 mol;
nH(ancol) = 2.nH2O = 2.0,6 = 1,2 mol
Ta có: m= mO(ancol) + mC(ancol) + mH(ancol )
= 0,26.16 + 0,34.12 + 1,2.1 = 9,44 gam
Sau khi đọc xong bài viết của chúng tôi bạn có thể biết được C2H4 ra C2H5OH để vận dụng vào làm các bài tập từ cơ bản đến nâng cao nhanh chóng nhé