Định nghĩa, tính chất vật lý, hóa học và cách điều chế khí Hidro kèm VD minh họa từ A – Z
Hidro là một trong những nguyên tốt khá là phổ biến ở tự nhiên nói chung và nói riêng trong hóa học. Ở bài viết dưới đây sẽ giải đáp cho chúng ta một số những vấn đề liên quan đến tính chất vật lý, tính chất hóa học của Hidro, cách điều chế Hidro cùng với cách điều chế cho nguyên tố này.
Tham khảo thêm:
- Tính chất của phi kim và các dạng bài tập liên quan chuẩn 100%
- Phenol là gì?Tính chất hóa học, công thức, cách điều chế phenol và các dạng bài tập
- Tính chất hóa học của clo và các dạng bài tập liên quan chuẩn 100%
Nội Dung
Hiđro là gì?
Hidro là một nguyên tố hóa học phi kim có số hiệu nguyên tử là 1 và nguyên tử khối cũng bằng 1. Cấu hình electron là 1s1, thuộc chu kì 1, nhóm IA. Kí hiệu là H.
Hidro bao gồm có một electron (e) có điện tích âm và quay xung quanh một proton mang điện tích dương. Proton này là hạt nhân của nguyên tử hidro, chúng được liên kết lại với nhau bằng lực Coulomb.
Tinh thể hiđro có cấu trúc hình lục phương. Hiđro có mang hóa trị 1 và có thể phản ứng được với hầu hết các nguyên tố khác.
Tính chất vật lý của hiđro
Ở điều kiện thường hidro tồn tại ở dạng phân tử H2 gồm hai nguyên tử hidro. Khí H2 nhẹ hơn không khí 14,5 lần, không màu, không mùi, ít tan trong nước, dễ cháy tạo thành hơi nước, có nhiệt độ sôi -252,87 °C và nhiệt độ nóng chảy -259,14 °C…
Khí hydro nhẹ nên trường hấp dẫn của Trái Đất không đủ mạnh để giữ chúng ở gần mặt đất, do đó khí hydro tồn tại chủ yếu trong các tầng cao của khí quyển Trái Đất. Còn lại hidro chủ yếu tồn tại ở dạng hợp chất.
Tính chất hóa học của hiđro
Hiđro tác dụng với oxi
Nếu đốt cháy hidro trong oxi: hidro cháy mạnh, trên thành lọ xuất hiện những giọt nước nhỏ
PTHH: 2H2 + O2 −to→ 2H2O
Hỗn hợp sẽ gây nổ nếu trộng hidro và oxi theo tỉ lệ thể tích 2:1
Hiđro tác dụng với oxit kim loại
Khi đốt nóng tới khoảng 400°C : bột CuO màu đen chuyển thành lớp kim loại đồng màu đỏ gạch và có những giọt nước tạo thành trên thành cốc
PTHH: H2 + CuO −to→ Cu +H2O
⇒ Hidro đã chiến oxi trong CuO. Vậy hidro có tính khử
⇒ở nhiệt độ thích hợp, hidro có thể kết hợp với nguyên tố oxi trong một số oxit kim loại. do vậy hidro có tính khử. Các phản ứng này đều tỏa nhiệt
Hidro tác dụng với phi kim
Tính chất hóa học đặc trưng của Hidro tiếp theo mà các em cần nhớ chính là Hidro có thể phản ứng với phi kim ở nhiệt độ cao.
PTHH: H2+Cl2 → 2HCl
Ứng dụng của hidro
+) Do tính chất nhẹ, tính khử và khih cháy tỏa nhiềt nhiệt mà hidro ứng dụng trong đời sống
+) Làm nguyên liệu cho động cơ tên lửa, nhiên liệu cho động cơ ô tô thay cho xăng
+) Làm nguyên liệu điều chế axit
+) Dùng để điều chế kim loại từ oxit của chúng
+) Bơm vào khinh khí cầu, bóng thám
Cách điều chế hidro
Trong phòng thí nghiệm
– Trong phòng thí nghiệm, khí hiđro được điều chế bằng cách cho axit (HCl hoặc H2SO4 loãng) tác dụng với kim loại kẽm (hoặc sắt, nhôm,…)
– Nguyên liệu:
+ Kim loại: Zn, Fe, Al,…
+ Dung dịch axit: HCl loãng, H2SO4 loãng.
PTHH: Zn + 2HCl → ZnCl2 + H2
Trong công nghiệp
Phương pháp điện phân nước.: 2H2O → 2H2↑ + O2↑
Dùng than khử oxi của H2O ở nhiệt độ cao: C + H2O → CO + H2
Điều chế từ khí tự nhiên, khí mỏ dầu.
Các dạng bài tập áp dụng tính chất của cacbon thường gặp
Câu 1: Tính thể tích hiđro (đktc) để điều chế 5,6 (g) Fe từ FeO?
Giải:
nFe= 5,6/56= 0,1mol
PTHH: FeO + H2![]() Fe + H2O
Fe + H2O
Tỉ lệ PT: 1mol 1mol
Phản ứng: 0,1mol ← 0,1mol
⇒VH2=0,1.22,4=2,24(l)
Cậu 2: Đốt cháy 2,8 lít H2 (đktc) sinh ra H2O
Giaỉ:
Số mol khí hiđro là:nH2 = V/ 22,4= 2,8/ 22,4= 0,125 mol
PTHH: 2H2 + O2![]() 2H2O
2H2O
Tỉ lệ PT: 2mol 1mol 2mol
P/ứng: 0,125mol → 0,0625mol→ 0,125mol
=> Thể tích khí oxi là: VO2=22,4.n=22,4.0,0625=1,4 lít
Câu 3: Cho 8 gam CuO tác dụng với 1,12 lít khí H2 ở nhiệt độ cao. Sau phản ứng thấy có m gam chất rắn. Giá trị của m là
Giải:
Số mol CuO là: nCuO = 8/80=0,1mol
Số mol khí H2 là:nH2 = 1,12/22,4= 0,05 mol
PTHH: CuO + H2![]() Cu + H2O
Cu + H2O
Vì đầu bài cho số mol 2 chất phản ứng => Xét tỉ lệ dư thừa
Ta có: n02/1=o,1>nh2/1=0,05 => CuO còn dư, H2 phản ứng hết
=> tính toán theo H2
Vì CuO còn dư nên chất rắn thu được sau phản ứng gồm Cu sinh ra và CuO dư
PTHH: CuO + H2![]() Cu + H2O
Cu + H2O
Tỉ lệ PT: 1mol 1mol 1 mol
P/ứng: 0,05mol ← 0,05mol → 0,05mol
=> Khối lượng Cu sinh ra là: mCu = 0,05.64 = 3,2 gam
Khối lượng CuO phản ứng là: mCuO phản ứng = 0,05.80 = 4 gam
=> Khối lượng CuO dư là: mCuO dư = mCuO ban đầu – mCuO phản ứng = 8 – 4 = 4 gam
=> Khối lượng chất rắn thu được sau phản ứng là
mchất rắn = mCu sinh ra + mCuO dư = 3,2 + 4 = 7,2 gam
Câu 4: Khử hoàn toàn 8 gam một oxit của kim loại R (có hoá trị II) cần vừa đủ 2,24 lít H2 (đktc). Kim loại R là:
Giải:
Gọi công thức của oxit là RO
PTHH: RO + H2→ R + H2O
nH2= 2,24/22,4= 0,1mol
Theo PTHH: nRO = nH2 = 0,1 (mol)
=> (R + 16).0,1 = 8
=> R + 16 = 80
=> R = 64 (Cu)
Câu 5 Những phản ứng hóa học nào dưới đây thường dùng để điều chế hiđro trong phòng thí nghiệm?
a. Zn + H2SO4 → ZnSO4 + H2↑
b. 2H2O điện phân→ 2H2↑ + O2↑
c. 2Al + 6HCl → 2AlCl3 + 3H2↑
d. Fe + H2SO4 → FeSO4 + H2↑
Giải:
Trong phòng thí nghiệm, khí hiđro được điều chế bằng cách cho axit (HCl hoặc H2SO4 loãng) tác dụng với kim loại như Zn, Fe, Al.
Những phản ứng hóa học thường dùng để điều chế hiđro trong phòng thí nghiệm là:
a. Zn + H2SO4 → ZnSO4 + H2↑
c. 2Al + 6HCl → 2AlCl3 + 3H2↑
d. Fe + H2SO4 → FeSO4 + H2↑
Câu 6: Trong phòng thí nghiệm có các kim loại kẽm và sắt, dung dịch axit clohiđric HCl và axit sunfuric H2SO4 loãng. Hãy viết các phương trình hóa học có thể điều chế hiđro.
Giải:
Phương trình hóa học có thể điều chế hiđro:
Zn + 2HCl → ZnCl2 + H2 ↑
Zn + H2SO4 (loãng) → ZnSO2 + H2 ↑
Fe + H2SO4 (lãong) → FeSO4 + H2 ↑
Fe + 2HCl → FeCl2 + H2 ↑
Câu 7: Trong giờ thực hành hóa học, học sinh A cho 32,5 gam kẽm vào dung dịch H2SO4 loãng, trong khí đó học sinh B cho 32,5 gam sắt cũng vào dung dịch H2SO4 loãng như ở trên. Hãy cho biết học sinh A hay học sinh B thu được nhiều khí hiđro (đo ở đktc) hơn?
Giải:
Học sinh A:
Số mol Zn là: nZn = 32,5/65= 0,5 mol
Zn + H2SO4 → ZnSO4 + H2↑
0,5 → 0,5 (mol)
Thể tích khí thu được là: VH2 = 22,4.nH2 = 22,4.0,5 = 11,2 lít
Học sinh B:
Số mol Fe là: nFe = 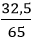
Fe + H2SO4 → FeSO4 + H2↑
0,58 → 0,58 (mol)
Thể tích khí thu được là: VH2 = 22,4.nH2 = 22,4.0,58 = 12,99 lít.
Vậy học sinh B thu được nhiều khí hiđro hơn.
Mong rằng những nội dung trên đây sẽ giúp bạn trả lời được những thắc mắc câu hỏi của mình. Hơn hết đó là có thể giải được những bài toán của mình