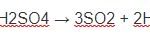Lý thuyết Al + H2SO4 → Al2(SO4)3 + SO2+ H2O và bài tập có đáp án
Al + H2SO4 → Al2(SO4)3 + SO2+ H2O là phương trình hóa học cho Al tác dụng với H2SO4 đặc nóng, sau phản ứng thu được nhôm sunfua và khí lưu huỳnh đioxit. Tất cả sẽ được THPT Chuyên Lam Sơn giải đáp chi tiết trong bài viết dưới đây để các bạn cùng tham khảo
Tham khảo thêm:
Nội Dung
Phương trình ứng nhôm tác dụng với H2SO4đặc nóng
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O
Điều kiện phản ứng nhôm tác dụng với H2SO4đặc nóng: Nhiệt độ thường
Cách tiến hành phản ứng Zn và dung dịch H2SO4 đặc: Bỏ mẩu nhôm vào ống nghiệm, sau đó nhỏ vài giọt dung dịch H2SO4 đặc nóng vào trong ống nghiệm đựng sẵn mẩu kẽm.
Hiện tượng sau phản ứng: Mẩu nhôm tan dần, xuất hiện khí không màu, có mùi hắc chính là lưu huỳnh đioxit (SO2)
Tính chất hóa học của nhôm
Tác dụng với oxi và một số phi kim.
4Al + 3O2→ 2Al2O3
ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững, lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng oxi trong không khí, nước.
2Al + 3Cl2 → 2AlCl3
Nhôm tác dụng với axit (HCl, H2SO4 loãng,..)
+) Tác dụng với axit (HCl, H2SO4 loãng,..)
2Al + 6HCl → 2AlCl3 + 3H2
Chú ý: Nhôm không tác dụng với H2SO4, HNO3đặc, nguội
+) Tác dụng với axit có tính oxi hóa mạnh như HNO3 hoặc H2SO4 đậm đặc
Al + 4HNO3→ Al(NO3)3 + NO + 2H2O
Al + 6HNO3 → Al(NO3)3 + 3NO2 + 3H2O
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O
Tác dụng với dung dịch muối của kim loại yếu hơn.
AI + 3AgNO3 → Al(NO3)3 + 3Ag
2Al + 3FeSO4 → Al2(SO4)3 + 3Fe
Tính chất hóa học riêng của nhôm.
+) Do lớp oxit nhôm bị hòa tan trong kiềm nên nhôm phản ứng với dung dịch kiềm.
2Al + 2H2O + 2NaOH → 2NaAlO2+ 3H2↑
Phản ứng nhiệt nhôm
+) Phản ứng nhiệt nhôm là phản ứng hóa học toả nhiệt trong đó nhôm là chất khử ở nhiệt độ cao.
Ví dụ nổi bật nhất là phản ứng nhiệt nhôm giữa oxit sắt III và nhôm:
Fe2O3+ 2Al → 2Fe + Al2O3
Bài tập phản ứng Al + H2SO4
Câu 1. Cho các lọ hóa chất mất nhãn được đựng trong các lọ riêng biệt sau: NaCl, MgCl2, FeCl2, FeCl3, AlCl3, NH4Cl, (NH4)2SO4. Chỉ được sử dụng 1 loại thuốc thử duy nhất để nhận biết các lọ hóa chất mất nhãn trên, hóa chất đó là:
Giải:
Trích mẫu thử và đánh số thứ tự
Dùng Ba(OH)2 dư cho từ từ vào các dung dịch mẫn nhãn trên
+) Ống nghiệm nào không có hiện tượng gì thì chất ban đầu là KCl
+) Ống nghiệm nào xuất hiện kết tủa trắng thì chất ban đầu là MgCl2
MgCl2 + Ba(OH)2→ Mg(OH)2↓ + BaCl2
+) Ống nghiệm nào xuất hiện kết tủa trắng xanh, sau đó một thời gian chuyển sang nâu đỏ thì chất ban đầu là FeCl2
FeCl2 + Ba(OH)2 → Fe(OH)2↓ + BaCl2
4Fe(OH)2 ↓trắng xanh + O2 + 2H2O → 4Fe(OH)3↓ nâu đỏ
+) Ống nghiệm nào xuất hiện màu nâu đỏ, thì chất ban đầu là FeCl3
2FeCl3+ 3Ba(OH)2 → 2Fe(OH)3↓ + 3BaCl2
+) AlCl3: Ban đầu xuất hiện kết tủa trắng keo, sau đó kết tủa tan dần đến hết
AlCl3+ Ba(OH)2 → Al(OH)3↓ + BaCl2
2Al(OH)3 + Ba(OH)2→ Ba(AlO2)2 + 4H2O
+) NH4Cl: xuất hiện khí trong dung dịch
2NH4Cl + Ba(OH)2 → BaCl2 + 2NH3↑ + H2O
+) (NH4)2SO4: đồng thời xuất hiện bọt khí và kết tủa trắng
(NH4)2SO4+ Ba(OH)2 → BaSO4↓ + 2NH3↑ + 2H2O
Câu 2. Hiện tượng quan sát được khi ta đổ từ từ dung dịch NaOH đến dư vào dung dịch AlCl3 là
Giải:
Hiện tượng quan sát được khi ta đổ từ từ dung dịch NaOH đến dư vào dung dịch AlCl3 là:
Xuất hiện kết tủa keo trắng đến cực đại, sau đó kết tủa tan từ từ đến khi cho dư NaOH, dung dịch thu được trong suôt
Phương trình hóa học: 3NaOH + AlCl3 → 3NaCl + Al(OH)3
NaOH + Al(OH)3 → NaAlO2 + 2H2O
Dung dịch NaAlO2là dung dịch trong suốt
Câu 3. Có 3 lọ không nhãn, mỗi lọ đựng một trong các chất rắn sau: Cu, Mg, Al. Thuốc thử để nhận biết 3 chất trên là
Giải:
Dể nhận biết 3 chất rắn trên thì ta dùng lần lượt dung dịch NaOH và HCl.
Cho dung dịch NaOH vào 3 ống nghiệm đựng chất rắn, chất rắn nào tan và sủi bọt khí là Al, 2 ống không hiện tượng là Cu và Mg
Phương trình hóa học: 2Al + 2NaOH + 2H2O → 2NaAlO2+ 3H2 ↑
Cho dung dịch HCl vào 2 chất rắn còn lại, chất rắn nào tan và sủi bọt khí là Mg, chất rắn không hiện tượng là Cu
Phương trình hóa học: Mg + 2HCl → MgCl2 + H2↑
Câu 4. Cho 2,7 gam bột nhôm tác dụng với 50 ml dung dịch NaOH 0,2M. Sau khi phản ứng xảy ra hoàn toàn thu được V lít khí hiđro (đktc). Giá trị của V là
Giải:
Phương trình hóa học
2Al + 2NaOH+ 2H2O → 2NaAlO2+ 3H2
0,1 0,1 mol
Sau phản ứng Al dư, NaOH hết
nkhí = 0,015 mol → V = 0,015.22,4 = 0,336 lít.
Câu 5. Dùng m gam Al để khử hết 3,2 gam Fe2O3 (phản ứng nhiệt nhôm). Sản phẩm sau phản ứng tác dụng với lượng dư dung dịch NaOH tạo 1,344 lít khí (đktc). Giá trị của m là
Giải:
Sản phẩm sau phản ứng tác dụng với dung dịch NaOH có khí thoát ra → Al dư
Phương trình phản ứng
2Al + Fe2O3→ 2Fe + Al2O3
0,04 0,02 mol
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
0,04 0,06 mol
→ nAl = 0,04 + 0,04 = 0,08 mol → mAl = 0,08.27 = 2,16 gam.
Câu 6. Cho dung dịch chứa FeCl2 và ZnCl2 tác dụng với dung dịch KOH dư, sau đó lấy kết tủa nung trong không khí đến khối lượng không đổi thu được chất rắn gồm:
Giải:
Phương trình phản ứng minh họa
FeCl2 + 2NaOH → Fe(OH)2 + 2KCl
ZnCl2+ 4KOH dư → K2ZnO2 + 2KCl + 2H2O
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Fe(OH)3 → Fe2O3 + H2O
Vậy chất rắn là Fe2O3
Câu 7. Cho a gam nhôm tác dụng với dung dịch H2SO4 (đặc, nóng, dư) sau khi phản ứng kết thúc người ta thu 13,44 lit khí SO2 (đktc). Giá trị a là
Giải:
nSO2 = 13,44/22,4 = 0,6 mol
Phương trình hóa học
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O
0,4 ← 0,6 mol
mAl = 0,4.27 = 10,8 gam
Câu 8. Một thanh kim loại A hóa trị II được nhúng vào trong 1 lít dung dịch CuSO40,5M. Sau khi lấy thanh A ra và cân lại thấy khối lượng thanh tăng 1,6 gam, nồng độ CuSO4 còn 0,3M. Hãy xác định kim loại A?
Giải:
A + Cu2+ → A2+ + Cu
Số mol Cu2+ phản ứng là: 1(0,5 – 0,3) = 0,2 mol
Độ tăng khối lượng của thanh kim loaị A:
mA = mCu– mA tan = 0,2(64 – A) = 1,6
Suy ra: A = 56 là Fe
Sau khi đọc xong bài viết của chúng tôi bạn có thể biết được Al + H2SO4 để vận dụng vào làm các bài tập từ cơ bản đến nâng cao nhanh chóng nhé