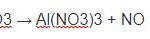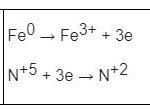Lý thuyết NO2 + O2 + H2O → HNO3 và bài tập có đáp án
NO2 + O2 + H2O → HNO3 là một trong những phương trình hóa học được ứng dụng rất nhiều trong bài tập và các đề thi hiện nay. Chính vì vậy, THPT Chuyên Lam Sơn biên soạn hướng dẫn bạn đọc viết phương trình NO2 ra HNO3 để các bạn tham khảo chi tiết dưới đây.
Tham khảo thêm:
- Lý thuyết về sự điện li của nước, pH, Chất chỉ thị Axit – bazơ và bài tập có lời giải từ A – Z
- Cấu hình electron nguyên tử là gì? Cách viết cấu hình electron nguyên tử kèm VD minh họa chính xác 100%
- Định nghĩa, tính chất vật lý, hóa học và cách điều chế khí Hidro kèm VD minh họa từ A – Z
Nội Dung
Phương trình phản ứng NO2 ra HNO3
⇒ 4NO2 + O2 + 2H2O → 4HNO3
Điều kiện để NO2 ra HNO3: không có
Cách tiến hành phản ứng để NO2 ra HNO3:
Cho NO2 tác dụng với O2 và hơi nước trong không khí
Hiện tượng phản ứng hóa học xảy ra
Khi cho NO2 tác dụng với O2 và hơi nước tạo ra axit nitric
Mở rộng kiến thức về NO2 (nitơ đioxit)
Khí NO2 là gì?
Công thức hóa học: NO2.
Khí NO2 hay có tên gọi khác là nitrit, khí nitơ đioxit hay điôxít nitơ. Nó là một trong các loại oxit nito.
Khí NO2 có màu nâu đỏ có mùi gắt rất đặc trưng. Vì thế khí NO2 có mùi dễ nhận biết hơn so với các khí độc khác và dễ dàng phát hiện ra nếu có rò rỉ.
Tính chất hóa học của NO2
NO2 tham gia vào phản ứng oxy hóa khử:
3NO2 + H2O → 2HNO3 + NO
(Trong phản ứng này ta thấy NO2 vừa là chất oxy hóa vừa là chất khử).
NO2 tham gia vào phản ứng quang hóa trong điều chế NO
NO2+ hv (λ < 430 nm) → NO + O
Bài tập phản ứng NO2 ra HNO3
Câu 1. Dãy các chất nào sau đây tác dụng với HNO3đặc nóng đều xảy ra phản ứng oxi hóa khử là
A. Fe, FeO, Fe(OH)2, Fe(OH)3
B. Fe, FeO, Fe(NO3)2, FeCO3
C. Fe, FeSO4, Fe2(SO4)3, FeCO3
D. Fe, FeO, Fe(NO3)2, Fe(NO3)3
Giải:
Phản ứng oxi hóa khử xảy ra khi Fe trong hợp chất chưa đạt số oxi hóa tối đa
Mà trong Fe(OH)3 , Fe2(SO4)3,Fe(NO3)3sắt có số oxi hóa +3 => A, C, D sai
Phương trình phản ứng minh họa cho đáp án đúng
Fe + 6HNO3 → Fe(NO3)3 + 3NO2 ↑ + 3H2O
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
Fe(NO3)2 + 2 HNO3 → Fe(NO3)3 + NO2 + H2O
FeCO3 + 4 HNO3 → Fe(NO3)3 + CO2 + NO2 + 2 H2O
Câu 2. Cho 150 ml dung dịch KOH 1M tác dụng với 200 ml dung dịch H3PO4 0,5M. Sau phản ứng, trong dung dịch chứa các muối
Giải:
Ta có:
nKOH= 0,15 (mol); nH3PO4 = 0,1 (mol)
Ta thấy: 1 < nKOH/ nH3PO4 = 0,15/0,1 = 1,5 < 2 → Tạo muối KH2PO4 và K2HPO4
KOH + H3PO4→ KH2PO4 + H2O
2KOH + H3PO4 → K2HPO4 + 2H2O
Câu 3. Cho kim loại Cu tác dụng với HNO3 đặc hiện tượng quan sát được là :
Giải:
Cho kim loại Cu tác dụng với HNO3 đặc hiện tượng quan sát được là: Khí màu nâu bay lên, dung dịch chuyển màu xanh
Phương trình phản ứng
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O
Câu 4. Hòa tan hết m gam FeS bằng một lượng tối thiểu dung dịch HNO3 (dung dịch X), thu được dung dịch Y và khí NO. Dung dịch Y hòa tan tối đa 1,92 gam Cu. Biết trong các quá trình trên, sản phẩm khử duy nhất của N+5 đều là NO. Số mol HNO3 trong X là
Giải:
nCu = 0,03 mol
Ta có: 2Fe3+ + Cu → 2Fe2+ + Cu2+
=> nFe3+(Y) =0,6 mol => nFeS = 0,6 mol
FeS → Fe3+ + S+6 + 9e
N+5 + 3e → N+2
=> Bảo toàn e: nNO =3.nFe3+ = 0,18 mol
Dung dịch Y chứa Fe2(SO4)3 và Fe(NO3)3
Bảo toàn nguyên tố S: nFe2(SO4)3=1/3.nFeS = 0,02 mol
Bảo toàn nguyên tố Fe và S :
nFeS = 2.nFe2(SO4)3 + nFe(NO3)3
=> nFe(NO3)3= 0,06 − 2.0,02 = 0,02 => nNO − 3nNO3− muối = 0,06 mol
Bảo toàn nguyên tố N: nHNO3 = nNO + nNO3− muối= 0,36 + 0,12 = 0,24 mol
Câu 5. Cho từ từ dung dịch NH3 đến dư vào dung dịch AlCl3. Hiện tượng quan sát được:
Giải:
Dẫn NH3vào dung dịch AlCl3 có phản ứng hóa học sau:
AlCl3 + 3NH3 + 3H2O → Al(OH)3+ 3NH4Cl
Vì NH3 là bazo yếu nên không thể hòa tan được hidroxit Al(OH)3
=> Hiện tượng: Có kết tủa keo trắng không tan
Câu 6. Chỉ dùng H2O và điều kiện đun nóng có thể tách hổn hợp nào sau đây?
Giải:
Chỉ dùng H2O và điều kiện đun nóng có thể tách hổn hợp: NH4Cl, CaSO4, MgSO4
Ta có NH4Cl, MgSO4 tan => Nhận ra CaSO4
Nung dung dịch chứa hai chất kia, NH4Cl phân hủy ra NH3, HCl nên thu được MgSO4.
Còn NH3, HCl, cho tái tại amoni là được NH4Cl.
Câu 7. Cho 30 gam hỗn hợp X gồm: Fe; FeO; Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư được 5,6 lít khí NO (đktc, sp khử duy nhất) và dung dịch Y. Số mol của HNO3 đã phản ứng là:
Giải:
Quy đổi 30 gam hỗn hợp X thành Fe, và O. Gọi x, y lần lượt là số mol của Fe và O =>
56x + 16y = 30 (1);
3x – 2y = 0,25.3 (2);
Từ 1, 2 => x = 0,45 và y = 0,3; nHNO3 = 4.nNO + 2nO = 4.0,25 + 2.0,3 = 1,6 mol
Câu 8. Đem nung hỗn hợp A gồm: x mol Fe và 0,15 mol Cu, trong không khí một thời gian, thu được 63,2 gam hỗn hợp B, gồm hai kim loại trên và hỗn hợp các oxit của chúng. Đem hòa tan hết lượng hỗn hợp B trên bằng dung dịch HNO3 đậm đặc, thì thu được 0,6 mol NO2. Trị số của x là:
Giải:
nO = y mol; nFe = x mol
56x + 0,15.64 + 16y = 63,2 (1);
3x + 0,15.2 = 2y + 0,6 (2)
Từ 1, 2 => x = 0,7 và y = 0,9
Sau khi đọc xong bài viết phương trình phản ứng NO2 ra HNO3 có thể giúp các bạn ứng dụng vào giải các bài tập nhanh chóng và chính xác nhất. Hãy thường xuyên theo dõi chúng tôi để được chia sẻ những kiến thức hữu ích khác về môn Hóa nhé