Tính chất vật lý, tính chất hóa học của Oxi và cách điều chế Oxi có bài tập minh họa chi tiết nhất
Oxi là một trong những nguyên tố hóa học quan trọng trong chương trình Hóa cấp 3. Trong bài viết dưới đây, Team Chúng tôi đã tổng hợp và chia sẻ đến những kiến thức về Oxi bao gồm công thức hóa học, tính chất vật lý, tính chất hóa học của Oxi cũng như cách điều chế và ứng dụng của hợp chất này. Các em hãy cùng theo dõi nhé!
Tham khảo thêm:
- Anken là gì? Tính chất hóa học, công thức, cách điều chế anken và các dạng bài tập
- Cách xác định hóa trị của 1 nguyên tố và các dạng bài tập
- Metan là gì? Tính chất hóa học, công thức tổng quát, cách điều chế Metan kèm bài tập từ A -Z
Nội Dung
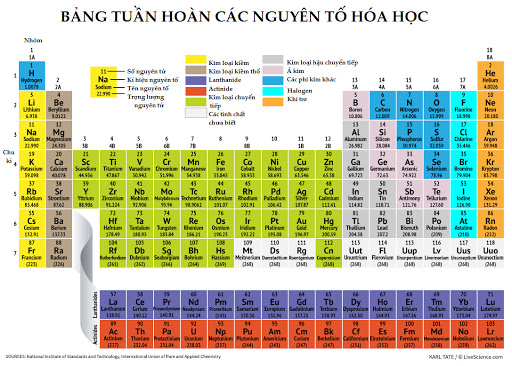
Oxi là gì?
Oxi là một nguyên tố hóa học phổ biến nhất trên trái đất. Nó chiếm tới 49,4% khối lượng vỏ trái đất. Ở dạng đơn chất, khí oxi có nhiều trong không khí. Ở dạng hợp chất, oxi tồn tại ở nhiều dạng hợp chất khác nhau như nước, đường, axit, quặng, đất đá . . .
– Kí hiệu hóa học của nguyên tố oxi là O
– Công thức hóa học của đơn chất (khí) oxi là O2
– Nguyên tử khối: 16
– Phân tử khối: 32
Tính chất vật lý và trạng thái tự nhiên của oxi
Tính chất vật lý:
Tính chất của oxi là một chất không có mùi, không có màu sắc, không có vị. Oxi tan ít trong nước và có khối lượng nặng hơn không khí. Khi chịu áp suất của khí quyển thì oxi sẽ hóa lỏng ở -183 độ. Khi hóa lỏng sẽ có màu xanh nhạt.
Có một số nghiên cứu oxi với không khí có tỉ khối là 32:29. Oxi tan rất ít trong nước. Nước ở nhiệt độ 20 độ C với 100ml, 1atm sẽ hoà tan được 3,1ml oxi. Khí oxi ở 20 độ C và 1atm sẽ có độ tan là 0,0043g tỉ trọng 100g H2O.
Trạng thái tự nhiên:
Oxi trong không khí là sản phẩm của quá trình quang hợp.
![]()
Tính chất hóa học của oxi
Trong mỗi điều kiện khác nhau thì oxi tác dụng với khá nhiều loại phi kim trong tự nhiên. Tuy nhiên, ở bài học về tính chất của oxi hóa 8 chúng ta cần nắm rõ thêm tác dụng của oxi với 2 nguyên tố phi kim là photpho(P) và lưu huỳnh(S).
Tác dụng với phi kim
– Với lưu huỳnh
+ Lưu huỳnh cháy trong không khí với ngọn lửa nhỏ, màu xanh nhạt; cháy trong khí oxi manh liệt hơn, tạo thành khí lưu huỳnh dioxit SO2 (còn gọi là khí sunfuro) và rất ít lưu huỳnh trioxit SO3
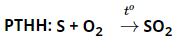
– Với photpho:
+ Photpho cháy mạnh trong oxi với ngọn lửa sáng chói, tạo khói trắng dày đặc bám vào thành lọ dưới dạng bột tan được trong không khí. Bột trắng đó là điphotpho pentaoxit có CTHH là P2O5
![]()
⇒ Vậy oxi có thể tác dụng với phi kim khi ở nhiệt độ cao. Trong hợp chất oxi hóa trị II
Tác dụng với kim loại
– Cho dây sắt cuốn một mẩu than hồng vào lọ khí oxi, mẩu than cháy trước tạo nhiệt độ đủ cao cho sắt cháy. Sắt cháy mạnh, sáng chói, không có ngọn lửa, không có khói, tạo ra các hạt nhỏ nóng chảy màu nâu là sắt (II, III) oxit, công thức hóa học là Fe3O4, thường được gọi là oxit sắt từ
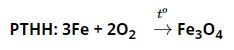
Tác dụng với hợp chất:
Khí metan (có trong khí bùn, ao, bioga) cháy trong không khí do tác dụng với oxi, tỏa nhiều nhiệt
![]()
⇒ Oxi có thể tác dụng với kim loại, phi kim và các hợp chất ở nhiệt độ cao. Trong các hợp chất hóa học oxi hóa trị II
Ứng dụng của Oxi
Oxi là một nguyên tố vô cùng quan trọng, ảnh hưởng đến sự sống của con người và động vật. Oxi không thể thiếu đối với quá trình hô hấp của mỗi người. Ngoài ra, Oxi còn được ứng dụng trong nhiều lĩnh vực như luyện thép, công nghiệp hóa chất, hàn cắt kim loại, y khoa,…
Cách điều chế Oxi
Điều chế Oxi trong phòng thí nghiệm
Trong phòng thí nghiệm, khí Oxi được điều chế bằng những cách sau đây:
+)Phân hủy các hợp chất giàu Oxi và ít bền với nhiệt như KClO3 (rắn), KMnO4 (rắn),…
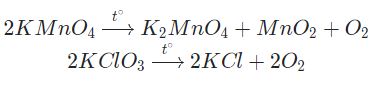
Phân hủy peoxit H2O2 với chất xúc tác là MnO2:
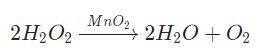
Điều chế Oxi trong công nghiệp
Từ không khí:
Không khí sau khi được loại bỏ hết bụi, hơi nước, khí cacbon đioxit sẽ được tiến hành hóa lỏng. Sau đó, người làm thí nghiệm tiến hành chưng cất phân đoạn không khí lỏng và thu được Oxi. Nguyên tử Oxi được vận chuyển trong những bình thép khép kín có dung tích 100 lít, dưới áp suất 150 atm.
Từ nước
Người làm thí nghiệm tiến hành điện phân nước (có hòa tan thêm một ít H2SO4 hoặc NaOH để tăng tính dẫn điện của nước), sau đó sẽ thu được khí Oxi (O2) ở cực dương và khí Hidro (H2) ở cực âm.
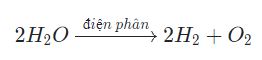
Các dạng bài tập áp dụng tính chất của oxi thường gặp
Câu 1: Đốt cháy hoàn toàn 24 kg than đá có chứa 0,5% tạp chất lưu huỳnh và 1,5% tạp chất khác không cháy được. Tính thể tích khí CO2 và SO2 tạo thành (ở điều kiện tiêu chuẩn)
Giải:
Trong than đá chứa: Cacbon (x%), lưu huỳnh (0,5%) và tạp chất khác (1,5%)
=> x = 100 – 0,5 – 1,5 = 98 (%)
=> trong 24 kg than đá chứa: 24.98% = 23,52 kg = 23520 gam cacbon; 24.0,5% = 0,12 kg = 120 gam lưu huỳnh; 24.1,5% = 0,36 kg = 360 gam tạp chất khác
=> số mol C là:nC = 23620/12= 1960 mol
Số mol S là:nS = 120/31=3,75mol
PTHH: C + O2→ CO2
Tỉ lệ PT: 1mol 1mol
Phản ứng: 1960mol → 1960mol
=> Thể tích khí CO2 sinh ra là:VCO2=22,4.1960=43904
PTHH: S + O2→ SO2
Tỉ lệ PT: 1mol 1mol
Phản ứng: 3,75mol → 3,75mol
=> Thể tích khí SO2 sinh ra là:VSO2=22,4.3,75=84 lít
=> tổng thể tích khí thu được là:V=VCO2+VSO2=43904+84=43988 lít
Câu 2 Tính khối lượng của N/2 nguyên tử oxi, của N/4 phân tử oxi và so sánh hai kết quả này.
Giải:
Hai khối lượng này giống nhau.
Vì khối lượng của N nguyên tử O là 16g
Nên khối lượng của N/2 nguyên tử O là 8g
Vì khối lượng của N phân tử O là 32(g)
Nên khối lượng của N/4 phân tử O là 8(g)
Vậy khối lượng của N/2 nguyên tử oxi bằng khối lượng của N/4 phân tử oxi
Câu 3: Cần bao nhiêu gam oxi để đốt cháy hết 2 mol lưu huỳnh?
Giải:
PTHH: S + O2→ SO2
Tỉ lệ PT: 1mol 1mol
Phản ứng: 2mol → 2mol
=> Khối lượng oxi cần dùng là: mO2=n.M=2.32=64gammO2=n.M=2.32=64gam
Câu 4: Đốt cháy 6,2 gam P trong bình chứa 6,72 lít khí oxi (đktc) tạo thành P2O5.
Giải:
Số mol của Photpho là:
![]()
Số mol oxi là:
![]()
Phương trình phản ứng: 4P + 5O2 → 2P2O5
Xét tỉ lệ phản ứng số mol chia cho hệ số phản ứng, ta có: 0,2/4<0,3/5
=> oxi dư, P phản ứng hết => phản ứng tính theo O
Câu 5: Tính số gam kali clorat cầm thiết để điều chế được 48 gam khí oxi?
Giải:
Số mol khí oxi thu được là: nO2 = 48/32=1,5 mol
PTHH: 2KClO3→ 2KCl + 3O2
Tỉ lệ theo PT: 2mol 3mol
Phản ứng: 1mol ← 1,5mol
=> Khối lượng KClO3 cần dùng là: mKClO3=n.M=1.(39+35,5+16.3)=122,5gam
Mong rằng những nội dung trên đây sẽ giúp bạn trả lời được những thắc mắc câu hỏi của mình. Hơn hết đó là có thể giải được những bài toán của mình