Phenol là gì?Tính chất hóa học, công thức, cách điều chế phenol và các dạng bài tập
Phenol tuy là một hóa chất độc hại, cấm dùng trong thực phẩm nhưng nó lại đóng vai trò quan trọng trong nhiều ngành khách. Hãy cùng chúng tôi tìm hiểu về phenol là gì và những ứng dụng của nó trong bài viết sau nhé.
Tham khảo thêm:
- Cách xác định hóa trị của 1 nguyên tố và các dạng bài tập
- Ankin là gì? Tích chất, công thức tổng quát, cách điều chế ankin và bài tập ứng dụng
- Định nghĩa, tính chất hóa học và công thức tổng quát của Axit Cacbonic và muối cacbonat kèm VD
Nội Dung
Phenol là gì
Phenol là dẫn xuất hiđrocacbon thơm trong đó 1 hay nhiều nguyên tử H của nhân benzen thay thế bằng nhóm –OH.
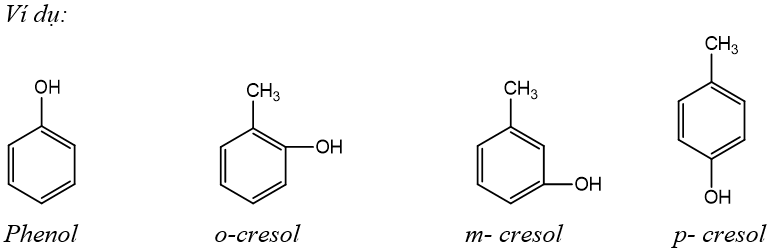
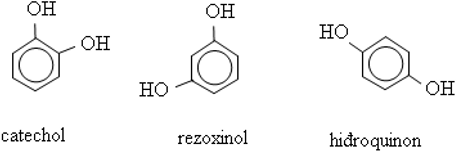
Các loại phenol
Những phenol mà phân tử có chứa 1 nhóm OH thì phenol thuộc loại monophenol.
Ví dụ: phenol, o- crezol, m- crezol, p-crezol, …
Những phenol mà phân tử có chứa nhiều nhóm OH thì phenol thuộc loại poliphenol.
Ví dụ:
Tính chất vật lý của phenol
Phenol là chất tinh thể không màu, nóng chảy ở nhiệt độ 42oC.
+) Ở nhiêt độ thường, phenol ít tan trong nước, khi đun nóng độ tan tăng lên. Khi đun nóng ở nhiệt độ 70oC trở lên thì tan vô hạn trong nước. Phenol tan nhiều trong rượu, ete, clorofom, …
+) Phenol độc, có tính sát trùng, làm bỏng da.
Tính chất hóa học của phenol
Nhân hút e, –OH đẩy e.
Tác dụng với kim loại kiềm:
C6H5OH + Na → C6H5ONa (Natri phenolat) + 1/2 H2↑
Tác dụng với bazơ:
C6H5OH (rắn, không tan) + NaOH → C6H5ONa (tan, trong suốt) + H2O
→ Phenol có tính axit, tính axit của phenol rất yếu; dung dịch phenol không làm đổi màu quỳ tím.
Chú ý: tính axit yếu, không làm đổi màu quỳ tím, thứ tự: nấc II của H2CO3 < phenol < nấc I của H2CO3.
⇒ Có phản ứng:
C6H5ONa (dd trong suốt) + H2O + CO2 → C6H5OH (vẩn đục) + NaHCO3
C6H5OH + Na2CO3 → C6H5ONa + NaHCO3
Phản ứng thế nguyên tử hiđro của vòng benzen
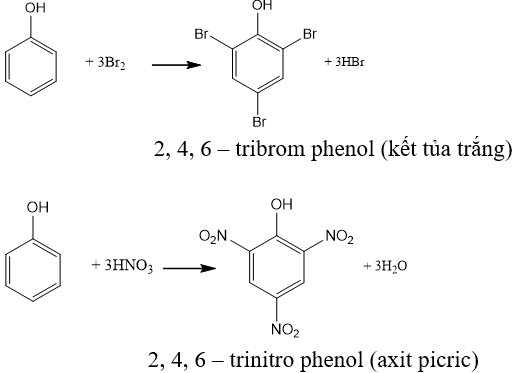
+ Phản ứng với H2:
![]()
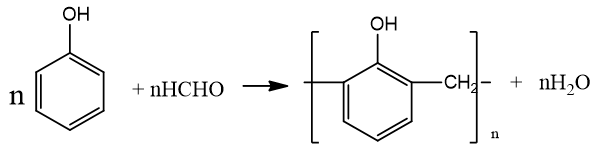
+ Phản ứng trùng ngưng với fomandehit:
Ứng dụng và điều chế
Ứng dụng:
- Phần lớn phenol dùng để sản xuất poli phenol – fomandehit.
- Điều chế dược phẩm, phẩm nhuộm, thuốc nổ (2,4,6- trinitrophenol), chất kích thích sinh trưởng thực vật, chất diệt cỏ, diệt sâu bọ, …
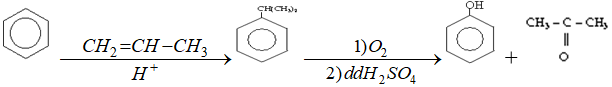
Điều chế phenol
+) Từ nhựa than đá:
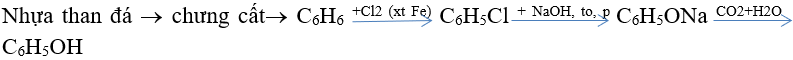
+) Trong công nghiệp điều chế đồng thời phenol và xeton như sau:
Các dạng bài tập thường gặp liên quan đến phenol
Câu 1: Cho các chất: phenol, p-metylphenol, p-nitrophenol và axit picric. Tính axit giảm dần theo thứ tự nào sau đây:
Giải:
axit picric có 3 nhóm NO2 hút e mạnh nên làm tăng tính axit nhiều nhất. Tiếp theo là p-nitrophenol với 1 nhóm hút e.
p-metylphenol có nhóm CH3 đẩy e làm giảm tính axit nên yếu nhất
Vậy axit picric > p-nitrophenol > phenol > p-metylphenol
Câu 2: Một dd X chứa 5,4 gam chất đồng đẳng của phenol đơn chức. Cho dd X phản ứng với nước brom (dư), thu được 17,25 gam hợp chất chứa 3 nguyên tử brom trong phân tử, giả sử phản ứng xảy ra hoàn toàn. Công thức phân tử chất đồng đẳng của phenol là
Giải:
X + 3Br2 → Y + 3HBr
Ta có 1 mol X → 1mol Y tăng 237g
5,4g X → 17,25g Y tăng 11,85g ⇒ nX = 11.85 : 237 = 0,05
⇒ MX = 5,4 : 0,05 = 108 ⇒ X là C7H7OH
Câu 3: Khi thổi khí CO2 dư vào dd C6H5ONa muối vô cơ thu được phải là NaHCO3 vì:
Giải:
Ta có H2CO3 có Ka 1 = 4,2 x 10-7; Ka 2 = 4,8 x 10-11; C6H5OH có Ka = 1,047 x 10-10
→ tính axit của H2CO3 > C6H5OH > HCO3–
Câu 4: Dung dịch A gồm phenol và xiclohexanol trong hexan (làm dung môi). Chia dung dịch A làm hai phần bằng nhau:
Giải:
Gọi số mol trong 1/2 dd A là: nC6H5OH = x mol; nC6H11OH = y mol
nH2 = 1/2. nC6H5OH + 1/2. nC6H11OH = 0,17 mol ⇒ x + y = 0,34 mol
n↓ = nC6H2OHBr3 = nC6H5OH = 0,18 mol ⇒ x = 0,18 ⇒ y = 0,16
⇒ mphenol = 0,18.94.2 = 33,84g; mxiclohexanol = 0,16.100.2 = 32g
Câu 5: Để nhận biết ba lọ mất nhãn: phenol, stiren, ancol benzylic, người ta dùng một thuốc thử duy nhất là:
Giải:
Dùng nước brom, chất nào làm mất màu dung dịch brom ⇒ stiren; chất nào tạo kết tủa trắng với nước brom ⇒ phenol; còn lại không hiện tượng gì là ancol benzylic
Câu 6: Để điều chế axit picric (2,4,6-trinitrophenol) người ta đi từ 4,7 gam phenol và dùng một lượng HNO3 lớn hơn 50% so với lượng HNO3 cần thiết. Số mol HNO3 đã dùng và khối lượng axit picric thu được lần lượt là (các phản ứng xảy ra hoàn toàn):
Giải:
nphenol = 4,7/94 = 0,05 mol => nHNO3 pư = 0,05.3 = 0,15 mol
=> nHNO3 dùng = 0,15.150/100 = 0,225 mol;
naxit picric = 0,05.229 =11,45 g
Câu 7: Cho m gam hỗn hợp X gồm phenol và etanol phản ứng hoàn toàn với natri (dư), thu được 2,24 lít khí H2 (đktc). Mặt khác, để phản ứng hoàn toàn với m gam X cần 100 ml dung dịch NaOH 1M. Giá trị của m là
Giải:
nH2 = 0,1 mol => nX = 0,2 mol; nphenol = 0,1 mol
=> netanol = 0,1 mol
=> m = 0,1.94 + 0,1.46 = 14 g
Câu 8: Cho hỗn hợp x gồm 2 a mol 2 phenol đồng đẳng kế tiếp. Nếu đốt cháy hoàn toàn X thu được 0,95 mol khí CO2 và 0,5 mol H2O. Mặt khác nếu hydro hóa hoàn toàn hết X cần b lít H2 (đktc). Vậy a và b có giá trị là:
Giải:
nX = 2a = (0,95-0,5)/3 = 0,15 mol => a = 0,075 mol => b = 0,15.3 = 0,45 mol
Mong rằng những nội dung trên đây sẽ giúp bạn trả lời được những thắc mắc câu hỏi của mình. Hơn hết đó là có thể giải được những bài toán của mình