Cấu hình electron nguyên tử là gì? Cách viết cấu hình electron nguyên tử kèm VD minh họa chính xác 100%
Trong chương trình Hóa học lớp 10, các em sẽ học về cấu hình electron nguyên tử, cách viết cấu hình electron cũng như những đặc điểm của lớp electron ngoài cùng. THPT Chuyên Lam Sơn sẽ giúp các em ghi nhớ những kiến thức này thông qua bài viết dưới đây.
Tham khảo thêm:
- Nitơ là gì? Tính chất hóa học, vật lý, cách điều chế Nitơ và bài tập có lời giải
- Định nghĩa, tính chất vật lý, hóa học và cách điều chế khí Hidro kèm VD minh họa từ A – Z
- Tính chất vật lý, tính chất hóa học của Oxi và cách điều chế Oxi có bài tập minh họa chi tiết nhất
Nội Dung
Cấu hình electron nguyên tử
Cấu hình electron nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
Người ta quy ước cách viết cấu hình electron nguyên tử như sau :
- Số thứ tự lớp electron được ghi bằng chữ số (1, 2, 3…).
- Phân lớp được ghi bằng các chữ cái thường (s, p, d, f).
- Số electron trong một phân lớp được ghi bằng số ở phía trên bên phải của phân lớp (s2, p6,…)
Đặc điểm của electron ngoài cung
+) Đối với nguyên tử của tất cả các nguyên tố, lớp electron ngoài cùng có nhiều nhất là 8 electron.
+) Các nguyên tử có 8 electron ở lớp electron ngoài cùng (ns2np6) và nguyên tử heli (1 s2) không tham gia vào các phản ứng hoá học (trừ trong một số điều kiện đặc biệt) vì cấu hình electron của các nguyên tử này rất bền. Đó là các nguyên tử của nguyên tố khí hiếm. Trong tự nhiên, phân tử khí hiếm chỉ có một nguyên tử.
+) Các nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng dễ nhường electron là nguyên tử của các nguyên tố kim loại (trừ H, He và B).
+) Các nguyên từ có 5, 6, 7 electron ở lớp ngoài cùng dễ nhận electron thường là nguyên tử của nguyên tố phi kim.
+) Các nguyên từ có 4 electron ngoài cùng có thể là nguyên tử của nguyên tố kim loại hoặc phi kim
Nguyên lý và quy tắc cần nhớ
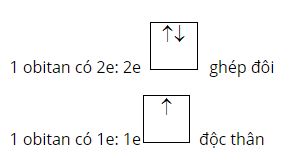
Nguyên lý Pauli: Trên 1 obitan có tối đa 2e và 2e này chuyển động tự quay khác chiều nhau:
Nguyên lý vững bền: Ở trạng thái cơ bản, trong nguyên tử các electron chiếm lần lượt các obitan có mức năng lượng từ thấp đến cao.
Quy tắc Hund: Trong 1 phân lớp, các electron sẽ phân bố trên các obitan sao cho số electron độc thân là tối đa và có chiều tự quay giống nhau
Trật tự các mức năng lượng nguyên tử: Trong nguyên tử, các electron trên các obitan khác nhau, nhưng cùng 1 phân lớp có mức năng lượng như nhau. Các mức năng lượng nguyên tử tăng dần theo trình tự:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Các bước viết cấu hình electron nguyên tử
- Bước 1: Xác định đúng số electron của nguyên tử.
- Bước 2: Các electron được phân bố lần lượt vào các phân lớp theo chiều tăng của năng lượng trong nguyên tử như: 1s 2s 2p 3s 3p 4s 3d 4p,… và tuân thủ theo quy tắc sau: Phân lớp s chứa tối đa 2e, phân lớp p chứa tối đa 6e, Phân lớp d chứa tối đa 10e và phân lớp f chứa tối đa 14e.
- Bước 3: Viết cấu hình electron bằng cách phân bố electron trên các phân lớp thuộc các lớp khác nhau như: 1s 2s 2p 3s 3p 4s 3d 4p,…
Lưu ý khi viết cấu hình e:
Sắp xếp cấu hình electron theo thứ tự từng lớp (1 → 7), trong mỗi lớp theo thứ tự từng phân lớp (s → p → d → f).
Cần xác định chính xác số electron nguyên tử hay ion (số e (electron) = số p (proton) = Z (số đơn vị điện tích hạt nhân)).
Nắm vững các quy tắc và nguyên lý, kí hiệu của lớp và phân lớp.
Nắm vững quy tắc bán bão hòa hay bão hòa trên phân lớp d và f.
Cách xác định nguyên tố s, p, d, f
- Nguyên tố s: có electron cuối cùng được viết vào phân lớp s
- Nguyên tố p: có electron cuối cùng được viết vào phân lớp p
- Nguyên tố d: có electron cuối cùng được viết vào phân lớp d
- Nguyên tố f: có electron cuối cùng được viết vào phân lớp f
Lưu ý một số trường hợp đặc biệt: Các nguyên tố có cấu hình nguyên tử bán bão hòa:
- Cr (có Z = 24) 1s22s22p63s23p63d44s2 chuyển thành 1s22s22p63s23p63d54s1.
- Cu (có Z = 29) 1s22s22p63s23p63d94s2 chuyển thành 1s22s22p63s23p63d104s1.
Các dạng bài tập cấu hình electron nguyên tử thường gặp
Câu 1. Cho biết tổng số electron trong anion AB32-là 42. Trong các hạt nhân A và B đều có số proton bằng số nơtron.
a. Tìm số khối của A và B
b. Cho biết vị trí của A, B trong bảng tuần hoàn
Giải:
a. Gọi số hạt proton của A là P và của B là P’, ta có:
P + 3P’ = 42 – 2. Ta thấy 3P’ < P + 3P’ = 40 nên P’ < 30/3= 13,3.
Do B tạo được anion nên B là phi kim. Mặt khác P’ < 13,3 nên B chỉ có thể là nitơ, oxi hay flo.
Nếu B là nitơ (P’ = 7) → P = 19 (K). Anion là KN32– -: loại
Nếu B là oxi (P’ = 8) → P = 16 (S). Anion là SO32– -: thỏa mãn
Nếu B là flo (P’ = 9) → P = 13 (Al). Anion là AF32– -: loại
Vậy A là lưu huỳnh, B là oxi.
b. O (P’ = 8) : 1s22s22p4 ⇒ ô số 8, chu kỳ 2, nhóm VIA.
S (P = 16) : 1s22s22p63s23p4 ⇒ ô số 16, chu kỳ 3, nhóm VIA.
Câu 2. Giả sử nguyên tố M ở ô số 19 trong bảng tuần hoàn chưa được tìm ra và ô này vẫn còn được bỏ trống. Hãy dự đoán những đặc điểm sau về nguyên tố đó:
a. Tính chất đặc trưng.
b. Công thức oxit. Oxit đó là oxit axit hay oxit bazơ?
Giải:
a, Cấu hình electron của nguyên tố đó là: 1s22s22p63s23p64s1
⇒ Electron lớp ngoài cùng là 1 nên tính chất đặc trưng của M là tính kim loại.
b, Nguyên tố đó nằm ở nhóm IA nên công thức oxit là M2O. Đây là một oxit bazơ
Câu 3. Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử X là 3s2. Số hiệu nguyên tử của nguyên tố X là
Giải:
Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử X là 3s2
Cấu hình e của X là: 1s22s22p63s2
X có 12 e nên có 12 p nên số hiệu nguyên tử của nguyên tố X là 12.
Câu 4: Trong nguyên tử X, lớp có mức năng lượng cao nhất là lớp M. Phân lớp p của lớp này có 4 electron. Số electron của nguyên tử X là
Giải:
Cấu hình electron phân lớp ngoài cùng của X là: 3p4 .
Vậy cấu hình electron của X là: 1s22s2p63s23p4 .
Số electron trong X là: 16.
Câu 5: Một nguyên tố có 3 lớp electron. Lớp ngoài cùng có 4 electron. Số hiệu nguyên tử của nguyên tố này là
Giải:
Cấu hình electron lớp ngoài cùng là: 3s23p2 .
Cấu hình electron nguyên tử của nguyên tố này là: 1s22s2p63s23p2 .
Có 14 electron trong nguyên tử. Số hiệu nguyên tử là 14.
Câu 6: Một nguyên tố d có 4 lớp electron, phân lớp ngoài cùng đã bão hòa electron. Tổng số electron s và electron p của nguyên tố này là
Giải:
Nguyên tố thuộc khối nguyên tố d có 4 lớp electron ⇒ electron cuối cùng trên phân lớp 3d.
Cấu hình electron của nguyên tố này có dạng: 1s22s22p63s23p63dX4s2 .
Vậy tổng số electron s và electron p là 20.
Câu 7: X là nguyên tố p. Biết rằng trong nguyên tử X, số electron p nhiều hơn số electron s là 9. Số electron ở lớp ngoài cùng của X là
Giải::
Giả sử X có n lớp electron.
Cấu hình electron lớp ngoài cùng là: ns2npx (2 ≤ x ≤ 6)
Tổng số electron s là 2n
Tổng số electron p là: 6(n-2) + x .
Theo đề: 6(n-2) + x – 2n = 9 ⇒ 4n + x = 21 .
Chọn cặp x = 1 và n = 5 .
Vậy số electron lớp ngoài cùng là 3.
Câu 8: X và Y là hai nguyên tố thuộc cùng nhóm A, ở hai chu kì lien tiếp, ZX < ZY và Y là nguyên tố thuộc chu kì lớn của bảng tuần hoàn. Biết rằng tổng số hạt proton, nơtron, electron trong X và Y là 156, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 36. X là
Giải:
X và Y là hai kim loại cùng nhóm A.
Y có nhiều hơn X là 8 hoặc 18 hoặc 32 electron.
Ta có: 2eY + 2eX + nX + nY = 156 (1)
2eY + 2eX – (nX + nY) = 36 (2)
Tính ra eY + eX = 48
Nếu eY – eX = 8 ⇒ eY = 28, eX = 20 (không thuộc 2 chu kì)(loại).
Nếu eY – eX = 18 ⇒ eY = 33, eX = 15
Vậy 2 nguyên tố này là As và P, cùng thuộc nhóm VA và thuộc 2 chu kì (nhận).
Nếu eY – eX = 32 ⇒ eY = 40, eX = 8 (không thuộc 2 chu kì liên tiếp) (loại).
Vậy X là photpho (P).
Mong rằng những nội dung trên đây sẽ giúp bạn trả lời được những thắc mắc câu hỏi của mình. Hơn hết đó là có thể giải được những bài toán của mình