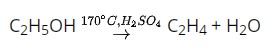Nitơ là gì? Tính chất hóa học, vật lý, cách điều chế Nitơ và bài tập có lời giải
Khái niệm Nitơ là gì? Tính chất vất lý hoặc tính chất hóa học của Nitơ là gì? Cách điều chế Nitơ như thế nào? Tất cả các câu hỏi của bạn sẽ được chúng tôi giải đáp kèm theo các dạng bài tập có lời chi tiết trong bài viết dưới đây để các bạn cùng tham khảo
Tham khảo thêm:
- Tính chất hóa học của kim loại và các dạng bài tập liên quan chuẩn 100%
- Độ tan là gì? Công thức tính độ tan và các dạng bài tập có lời giải chi tiết nhất
- Anken là gì? Tính chất hóa học, công thức, cách điều chế anken và các dạng bài tập
Nội Dung
Định nghĩa Nitơ là gì?
Nitơ (tên tiếng Anh là nitrogen) là một nguyên tố hóa học ở vị trí thứ 7, chu kì 2, thuộc nhóm VA trong bảng tuần hoàn hóa học. Kí hiệu: N2 và thường tồn tại ở dạng khí với liên kết 3.
Nito là thành phần chính của khí quyển, góp phần trong việc bảo vệ trái đất khỏi sự tác động, phá hủy của bức xạ mặt trời. Nito có công thức hóa học là N2.
Khí Nito chiếm khoảng 78% và đây thành phần của mọi cơ thể sự sống. Nito có hai dạng có tính ứng dụng cao đó là khí Nito khí và Nito lỏng. Trong đó nito lỏng sẽ được mọi người bắt gặp thường xuyên hơn bởi những đặc tính hữu ích của nó.
Số oxi hóa của N2: -3, 0, +1, +2, +3, +4, +5.
Trạng thái tự nhiên của Nitơ
Trong tự nhiên, nito tồn tại ở dạng tự do và dạng hợp chất.
- Ở dạng tự do, nito chiếm 80% thể tích không khí.
- Ở dạng hợp chất, nito có nhiều trong khoáng vật NaNO3 có tên là diêm tiêu natri.
Ngoài ra nito có trong thành phần của protein, axit ucleic, … và nhiều hợp chất hữu khác.
Tính chất vật lý của nito
+) Nito là chất khí không màu, không mùi, không vị, hơi nhẹ hơn không khí (d = 28/29), hóa lỏng ở -196 ºC.
+) Ít tan trong nước (ở điều kiện thường, 1 lít nước hòa tan được 0.015 lít khí nitơ)
+) Nhiệt độ hóa lỏng ở – 196 độC và nhiệt độ hóa rắn cũng rất thấp. Nitơ lỏng là một dạng hợp chất giống nước nhưng chỉ có 80.8% nitơ ở điểm sôi, hằng số điện môi là 1.4.
+) Không duy trì sự cháy và sự sống.
Tính chất hóa học của Nitơ
+) N2 có số oxi hoá 0 nên vừa thể hiện tính oxi hoá và tính khử.
+) Nitơ có EN N = 946 kJ/mol, ở nhiệt độ thường nitơ khá trơ về mặt hóa học nhưng ở nhiệt độ cao hoạt động hơn.
+) Nitơ thể hiện tính oxi hóa và tính khử, tính oxi hóa đặc trưng hơn.
Tính oxi hoá của nito
Phân tử nitơ có liên kết ba rất bền, nên nitơ khá trơ về mặt hóa học ở nhiệt độ thường.
+)Tác dụng với hidro: Ở nhiệt độ cao, áp suất cao và có xúc tác. Nitơ phản ứng với hidro tạo amoniac.
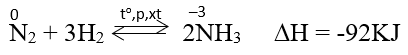
+)Tác dụng với kim loại
– Ở nhiệt độ thường nitơ chỉ tác dụng với liti tạo liti nitrua: 6Li + N2 → 2Li3N.
– Ở nhiệt độ cao, nitơ tác dụng với nhiều kim loại: 3Mg + N2 → Mg3N2 (magie nitrua).
Lưu ý:
- Các nitrua dễ bị thủy phân tạo NH3.
- Nitơ thể hiện tính oxi hoá khi tác dụng với nguyên tố có độ âm điện nhỏ hơn.
Tính khử của nito
+) Ở nhiệt độ cao (3000 ºC) Nitơ phản ứng với oxi tạo nitơ monoxit.
![]()
+) Ở điều kiện thường, nitơ monoxit tác dụng với oxi không khí tạo nitơ đioxit màu nâu đỏ.
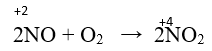
Nitơ thể hiện tính khử khi tác dụng với nguyên tố có độ âm điện lớn hơn.
– Các oxit khác của nitơ: N2O, N2O3, N2O5 không điều chế được trực tiếp từ nitơ và oxi.
Chú ý: Nitơ thể hiện tính khử khi tác dụng với các nguyên tố có độ âm điện lớn hơn. Thể hiện tính oxi hóa khi tác dụng với các nguyên tố có độ âm điện lớn hơn.
Cách điều chế Nitơ
Người ta thông thường điều chế Nitơ trong phòng thí nghiệm và công nghiệp
Điều chế nitơ trong phòng thí nghiệm
Trong phòng thí nghiệm, người ta điều chế nitơ tinh khiết bằng cách đun nóng nhẹ dung dịch bão hòa muối amoni nitrit (hoặc thay thế bằng amoni clorua và natri nitrit).
Phương trình:
NH4NO2 → N2 (↑) + 2H2O (nhiệt độ)
NH4Cl + NaNO2 → N2 (↑) + NaCl + 2H2O (nhiệt độ)
Bên cạnh đó, để điều chế nitơ trong phòng thí nghiệm, người ta cũng có thể đun nóng amoni dicromat (NH4)2Cr2O7 hoặc phân hủy nhiệt Natri Azide hoặc Bari Azide.
Sản xuất nitơ trong công nghiệp
Trong công nghiệp, nitơ được sản xuất bằng phương pháp chưng cất phân đoạn không khí lỏng dưới áp suất cao và nhiệt độ cực thấp sau khi loại bỏ CO2 và hơi nước. Khi nhiệt độ không khí lỏng được nâng đến -196 độ C, nitơ sôi và được lấy ra.
Bên cạnh đó, nitơ trong công nghiệp cũng được điều chế bằng phương pháp cơ học lọc màng, sử dụng áp suất (PSA).
Các dạng bài tập ứng dụng về Nitơ từ cơ bản đến nâng cao có lời giải
Câu 1: Thủy phân hoàn toàn 4,878 gam halogenua của photpho thu được hỗn hợp hai axit. Để trung hòa hoàn toàn hỗn hợp này cần 90 ml dung dịch NaOH 1M. Halogen đó là
Giải:
PX3 (x) + 3H2O → 3HX (3x) + H3PO3 (x mol)
nNaOH = nHX + 2nH3PO3 = 5x = 0,09 mol (axit H3PO3 là axit 2 nấc )
⇒ x = 0,018 mol
⇒ PX3 = 4,878 : 0,018 = 271 ⇒ X = 80 (Br)
Câu 2: Cho m gam hỗn hợp X gồm Al và Mg tác dụng hết với dung dịch HCl dư tạo ra 8,96 lít khí H2 (đktc). Cũng m gam hỗn hợp X tác dụng với dung dịch HNO3 loãng dư tạo ra 5,75 gam hỗn hợp khí Y gồm NO và N2O dung dịch thu được sau phản ứng chỉ có hai muối. Thể tích của hỗn hợp Y (đktc) là
Giải:
nNO = x mol; nN2O = y mol;
⇒ 30x + 44y = 5,75 g (1)
Bảo toàn e ta có: ne cho = ne nhận = 2nH2 = 0,8mol
⇒ 3x + 8y = 0,8 (2)
Từ (1)(2) ⇒ x = 0,1 mol; y = 0,0625 mol ⇒ VY = 3,64 lít
Câu 3: Nung 6,58 gam Cu(NO3)2 trong bình kín, sau một thời gian thu được 4,96 gam chất rắn và hỗn hợp khí X. Hấp thụ hoàn toàn hỗn hợp X vào nước được 300 ml dung dịch Y. pH của dung dịch Y là
Giải:
2Cu(NO3)2 –H = 80%→ 2CuO + 4NO2 (4x) + O2 (x mol)
mc/rắn giảm = mkhí = 6,58 – 4,96 = 1,62 gam ⇒ mNO2 + mO2 = 1,62
46. 4x + 32x = 1,62 ⇒ x = 0,0075 mol
nNO2 = nHNO3 = nH+ = 0,03 ⇒ [H+] = 0,1 ⇒ pH = 1,0
Câu 4: Supephotphat đơn được điều chế từ một loại bột quặng chứa 73% Ca(PO4)2, 26% CaCO3 và 1% SiO2. Khối lượng dung dịch H2SO4 65% tác dụng với 100kg quặng kẽm khi điều chế supephotphat đơn là
Giải:
nCa3(PO4)2 = 0,235 kmol; nCaCO3 = 0,26Kmol
Điều chế supephotphat đơn: nH2SO4 = 2 nCa3(PO4)2 + nCaCO3 = 0,73 kmol
⇒ mdd = 0,73. 98 : 65% = 110,2 kg
Câu 5: Cho a mol P2O5 vào 200ml dung dịch NaOH thì thu được dung dịch chúa 0,15 mol Na2HPO4 và 0,25 mol NaH2PO4. Giá trị của a và nồng độ mol của NaOH là
Giải:
Bảo toàn nguyên tố:
nP2O5 = 1/2. nNa2HPO4 + 1/2. nNaH2PO4 = 0,2 mol = a
nNaOH = 2nNa2HPO4 + nNaH2PO4 = 0,55 mol ⇒ CM NaOH = 2,75 mol
Câu 6: Một bình kín có thể tích là 0,5 lít chứa 0,5 mol H2 và 0,5 mol N2, ở nhiệt độ (toC). Khi ở trạng thái cân bằng có 0,2 mol NH3 tạo thành. Hằng số cân bằng KC của phản ứng tổng hợp NH3 là :
Giải:
Theo giả thiết ta thấy ban đầu [H2] = [N2] = 1M.
Thực hiện phản ứng tổng hợp NH3 đến thời điểm cân bằng [NH3] = 0,4M
Phương trình phản ứng hoá học :
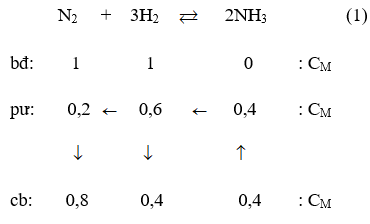
Theo (1) tại thời điểm cân bằng [NH3] = 0,8M; [H2] = 0,4M; [NH3] = 0,4M.
Vậy hằng số cân bằng của phản ứng tổng hợp NH3 là :
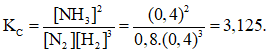
Câu 7: Hỗn hợp X gồm N2 và H2 có MX = 12,4. Dẫn X đi qua bình đựng bột Fe rồi nung nóng biết hiệu suất tổng hợp NH3 đạt 40% thì thu được hỗn hợp Y. MY có giá trị là :
Giải:
Áp dụng sơ đồ đường chéo cho hỗn hợp N2 và H2 ta có :
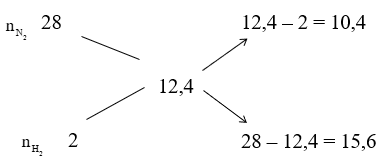
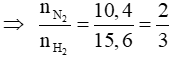
Với tỉ lệ trên suy ra H2 thiếu, hiệu suất phản ứng tính theo H2.
Trong hỗn hợp X ta chọn
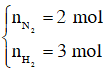
Số mol H2 phản ứng là 3.40% = 1,2 mol, suy ra số mol N2 phản ứng là 0,4 mol, số mol NH3 sinh ra là 0,8 mol. Sau phản ứng số mol khí giảm là (1,2 + 0,4) – 0,8 = 0,8 mol.
Sau phản ứng số mol khí giảm là 0,8 mol nên: nY = nX – 0,8 = 2 + 3 – 0,8 = 4,2 mol
Theo định luật bảo toàn khối lượng ta có: mY = mX = mN2 + mH2 = 2.28 + 3.2 = 62 gam
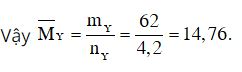
Sau khi đọc xong bài viết của chúng tôi các bạn có thể nắm được tính chất vật lý, tính chất hóa học của Nitơ để điều chế Nitơ thành công cũng như ứng dụng vào để làm bài tập. Cảm ơn các bạn đã theo dõi bài viết của chúng tôi nhé