Metan là gì? Tính chất hóa học, công thức tổng quát, cách điều chế Metan kèm bài tập từ A -Z
Metan là một hợp chất khí quen thuộc với con người, chúng tan tại xung quanh chúng ta. Tuy nhiên không phải ai cũng hiểu rõ về tính chất lý hóa cũng như vai trò, công dụng của chúng trong đời sống. Bài viết dưới đây chúng tôi sẽ cung cấp cho bạn đọc những thông tin hữu ích về hợp chất khí này. Hãy cùng theo dõi nhé!
Tham khảo thêm:
- Ankin là gì? Tích chất, công thức tổng quát, cách điều chế ankin và bài tập ứng dụng
- Ankan là gì? Công thức tổng quát, tính chất và cách điều chế ankan kèm theo bài tập
- Bảng hóa trị của các nguyên tố và cách học thuộc bằng bài ca hóa trị
Nội Dung
Metan là gì?
Khí metan (methane) hay còn khí bùn ao là một hidrocacbon nằm trong dãy đồng đẳng akan, được kí hiệu là CH4 trong hóa học.
Chúng là thành phần chính của khí dầu mỏ, có trong tự nhiên khá nhiều. Metan được tạo ra trong quá trình chế biến, chưng cất hay sản xuất khí dầu mỏ. Chính vì vậy nó cũng xuất hiện trong gia đình của bạn vì nó có trong các bình gas
Tính chất vật lí của metan
- Meta là chất khí không màu không mùi, không vị. Chúng rất độc và dễ bắt cháy, tạo ra lửa màu xanh.
- CH4 hóa lỏng khi ở −162 °C, hóa rắn ở −183 °C
- Điểm bốc cháy là 537 °C
- Khối lượng riêng của metan là 0.717 kg/m3
- Metan không có khả năn hòa tan trong các dung môi phân cực vì không có sư liên kết giữa các hidro, chúng chỉ tan trong dung môi không phân cực.
- CH4 không có tính dẫn điện.
Tính chất hóa học của metan
+) Phản ứng thế với halogen clo, brom
Mêtan phản ứng với Halogen cho ra dẫn xuất halogen và hidro halogenua.
Ví dụ đối với Cl: Metan phản ứng với Clo trong ánh sáng khuếch tán theo nhiều giai đoạn:
- CH4 + Cl2 → CH3Cl + HCl
- CH3Cl + Cl2 → CH2Cl2 + HCl
- CH2Cl2 + Cl2 → CHCl3 + HCl
- CHCl3 + Cl2 → CCl4 + HCl
+) Phản ứng với hơi nước tạo khí CO
CH4 + H2O = CO + H2O
Điều kiện phản ứng: Nhiệt độ 1000, Chất xúc tác Ni
+) Phản ứng cháy với oxi
Phản ứng cháy hoàn toàn:
CH4 + 2O2 → CO2 + 2H2O + Q
Q= −891 kJ/mol ở 25oC, 1 atm
Phản ứng cháy không hoàn toàn: Được dùng trong sản xuất fomanđehit, bột than, khí đốt,…
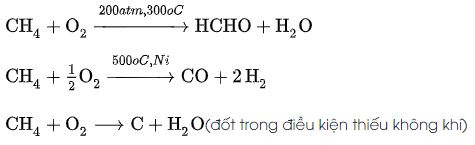
+) Phản ứng phân hủy tạo axetilen
Metan bị nhiệt phân bằng cách nung nóng nhanh metan với 1 lượng nhỏ oxi ở nhiệt độ khoảng 1500oC:
![]()
Oxi được dùng để đốt cháy 1 phần metan, cung cấp thêm nhiệt cho phản ứng.
Cách điều chế metan
Điều chế metan trong phòng thí nghiệm
Một số cách phổ biến điều chế CH4 trong phòng thí nghiệm như sau:
Khi cần một lượng nhỏ khí metan, người ta nung natri axetat chung với vôi tôi xút, hoặc điều chế bằng cách cho nhôm cacbua tác dụng với nước.
- Điều chế CH4 từ nhôm cacbua:
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
- Phản ứng muối natri axetat với xút tạo khí metan (nhiệt phân muối natri của axit cacboxylic):
CH3–COONa + NaOH →(CaO, nhiệt độ) Na2CO3 + CH4
- Cách điều chế metanol bằng phản ứng cộng hidro vào cacbon:
C + 2H2 →(nhiệt độ, Ni) CH4
- Cách điều chế CH4 từ khí CO:
CO + 3H2 →(nhiệt độ) H2O+CH4
Hoặc điều chế CH4 bằng cách khử các dẫn xuất methyl của các halogen, ancol hay carbonyl.
Điều chế metan trong công nghiệp
Trong công nghiệp, Metan và các đồng đẳng được tách từ khí thiên nhiên và dầu mỏ. Đây là cách điều chế CH4 dễ dàng và nhanh chóng nhất.
Ứng dụng metan
Metan được ứng dụng rất nhiều trong đời sống và sản xuất
CH4 là một nhiên liệu không thể thiếu trong đời sống, đặc biệt chúng có trong khí gas. Khi nấu bằng khí gas hay đồ sưởi ấm giúp bạn giảm bớt lượng thải CO, CO2 ra ngoài không khí thay vì dùng bằng than hay củi.
Ứng dụng của khí metan
Metan là một trong những loại nguyên liệu quan trọng không thể thiếu trong quá trình sản xuất công nghiệp và sinh hoạt hàng ngày của con người.
Ứng dụng CH4 làm các nhiên liệu:
CH4 cũng chính là một nhiên liệu không thể thiếu trong đời sống, đặc biệt có trong khí gas. Nấu bằng khí gas, đồ sưởi ấm giúp bạn giảm bớt lượng thải CO, CO2 ra ngoài không khí thay vì dùng bằng than, củi.
Ứng dụng CH4 vào công nghiệp:
Metan khá “ tích cực “ trong các phản ứng hóa học ở nhiều dạng khác nhau: rắn, lỏng, khí. Trong các ngành công nghiệp hóa học, metan là nguyên liệu tạo ra một số chất như hydro, methanol, axit axetic và anhydrit axetic.
Các dạng bài tập metan thường gặp
Bài 1: Đốt cháy hoàn toàn 11,2 lít khí metan (đktc). Hãy tính thể tích khí oxi cần dùng và thể tích khí cacbonic tạo thành. Biết thể tích các khí đo ở đktc.
Giải:
nCH4 = 11,2/22,4 = 0,5 mol
Phương trình phản ứng:
CH4 + 2O2 → CO2 + 2H2O
Theo phương trình: nO2 = 2 x nCH4 = 2 x 0,5 = 1 mol.
nCO2 = nCH4 = 0,5 mol.
VO2 = 1 x 22,4 = 22,4 lít.
VCO2 = 0,5 x 22,4 = 11,2 lít.
Bài 2: Có một hỗn hợp khí gồm CO2 và CH4. Hãy trình bày phương pháp hóa học để:
a) Thu được khí CH4.
b) Thu được khí CO2.
Giải:
Phương pháp hóa học để:
a) Thu được khí CH4:
Dẫn hỗn hợp khí qua dung dịch Ca(OH)2 dư, khí CO2 bị giữ lại do phản ứng tạo ra CaCO3, khí bay ra khỏi dung dịch là CH4 có lẫn hơi nước nên dùng CaO làm khô để thu được CH4 tinh khiết. Ta có PTHH như sau:
CO2 + Ca(OH)2 → CaCO3↓ + H2O.
b) Cho CaCO3 thu được ở trên tác dụng với dung dịch HCl loãng ta sẽ thu được khí CO2. Làm lạnh ngưng tụ nước sẽ thu được CO2 tinh khiết/ Ta có PTHH như sau:
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
Bài 3: Đốt cháy hoàn toàn 3,36 lít khí metan (đktc). Lấy sản phẩm thu được hấp thụ hoàn toàn vào nước vôi trong dư thấy xuất hiện m gam kết tủa. Giá trị của m là
Giải:
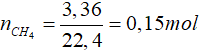
CH4 + 2O2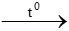 CO2 + 2H2O
CO2 + 2H2O
0,15 → 0,15 mol
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,15 mol → 0,15 mol
mCaCO3 = 0,15.100 = 15 gam
Bài 4: Cho 2,24 lít khí metan (đktc) phản ứng hoàn toàn với V lít khí Cl2 cùng điều kiện thu được chất A và HCl. Biết clo chiếm 83,53% khối lượng của A. Giá trị của V là
Giải:
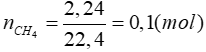
CTPT của A là CH4-xClx
Ta có:
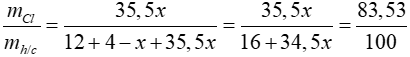
=> x = 2
=> A là CH2Cl2
Pthh: CH4 + 2Cl2 → CH2Cl2 + 2HCl
2,24 → 4,48 lít
=> V = 4,48 (l)
Mong rằng những nội dung trên đây sẽ giúp bạn trả lời được những thắc mắc câu hỏi của mình. Hơn hết đó là có thể giải được những bài toán của mình