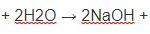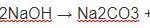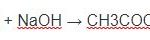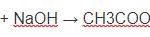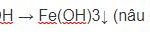Lý thuyết Al + H2O + NaOH → NaAlO2 + H2 và bài tập có đáp án
Al + NaOH + H2O → NaAlO2 + H2 à phương trình phản ứng hóa học khi cho Al tác dụng với NaOH, sản phẩm tạo ra là natri aluminat và khí Hidro thoát ra. Sau đây, THPT CHuyên Lam Sơn sẽ giúp bạn cân bằng phản ứng và giải bài tập liên quan đến phương trình phản ứng trên trong bài viết dưới đây
Tham khảo thêm:
Nội Dung
Phương trình phản ứng Al tác dụng với NaOH :
2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2↑
Điều kiện phản ứng Al ra NaAlO2: Nhiệt độ: Từ 400oC – 500oC
Phương trình ion rút gọn khi cho Al tác dụng NaOH
+) Phương trình phân tử
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
+) Phương trình ion rút gọn
2Al + 2H2O + 2OH– → 2AlO2– + 3H2
Cách tiến hành phản ứng cho Al tác dụng với NaOH: Cho đồng Al tác dụng với dung dịch bazo NaOH
Hiện tượng Hóa học
+) Kim loại Al tan dần trong dung dịch và xuất hiện bọt khí, khí thoát ra chính là hidro H
+) Bản chất của phản ứng nhôm tác dụng với dung dịch kiềm như sau:Ở điều kiện bình thường nhôm có lớp oxit Al2O3 rất mỏng, bền và mịn bảo vệ nhôm nên nhôm không tác dụng với nước. Khi nhôm tiếp xúc với dung dịch kiềm thì lớp oxit Al2O3này sẽ bị kiềm hòa tan, khi đó nhôm không còn màng oxit bảo vệ, nhôm sẽ tác dụng với nước theo phương trình sau:
2Al + 6H2O → 2Al(OH)3↓+ 3H2↑ (1)
+) Al(OH)3 tác dụng tiếp với dung dịch kiểm theo phương trình:
Al(OH)3 + NaOH → NaAlO2 + H2O (2)
+) Vậy phản ứng nhôm tan trong dung dịch kiểm là sự tổng hợp của phương trình (1),(2) và giải phóng khí H2:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Tính chất hóa học của nhôm
Tác dụng với oxi và một số phi kim.
4Al + 3O2→ 2Al2O3
Ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững, lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng oxi trong không khí, nước.
2Al + 3Cl2 → 2AlCl3
Nhôm tác dụng với axit (HCl, H2SO4 loãng,..)
+) Tác dụng với axit (HCl, H2SO4 loãng,..)
2Al + 6HCl → 2AlCl3 + 3H2
Chú ý: Nhôm không tác dụng với H2SO4, HNO3đặc, nguội
+) Tác dụng với axit có tính oxi hóa mạnh như HNO3 hoặc H2SO4 đậm đặc
Al + 4HNO3→ Al(NO3)3 + NO + 2H2O
Al + 6HNO3 → Al(NO3)3 + 3NO2 + 3H2O
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O
Tác dụng với dung dịch muối của kim loại yếu hơn.
AI + 3AgNO3 → Al(NO3)3 + 3Ag
2Al + 3FeSO4 → Al2(SO4)3 + 3Fe
Tính chất hóa học riêng của nhôm.
+) Do lớp oxit nhôm bị hòa tan trong kiềm nên nhôm phản ứng với dung dịch kiềm.
2Al + 2H2O + 2NaOH → 2NaAlO2+ 3H2↑
Phản ứng nhiệt nhôm
+) Phản ứng nhiệt nhôm là phản ứng hóa học toả nhiệt trong đó nhôm là chất khử ở nhiệt độ cao.
Ví dụ nổi bật nhất là phản ứng nhiệt nhôm giữa oxit sắt III và nhôm:
Fe2O3+ 2Al → 2Fe + Al2O3
+) Một số phản ứng khác như:
3CuO+ 2Al → Al2O3 + 3Cu
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
Bài tập phản ứng Al + NAOH
Câu 1. Hòa tan hết a mol Al vào dung dịch chứa 2a mol NaOH thu được dung dịch X. Kết luận nào sau đây đúng
Giải:
Phương trình phản ứng hóa học
Al + 2H2O + 2NaOH → 3H2 + 2NaAlO2
a a a (mol)
Dung dịch X gồm: NaOH dư (a mol) và NaAlO2 (a mol)
A. 2H2O + NaAlO2 + CO2 → Al(OH)3 + NaHCO3
a a a (mol)
NaOH + CO2 → Na2CO3
B. CuSO4 + NaOH → Cu(OH)2 + Na2SO4
C. HCl + NaOH → NaCl + H2O
a a (mol)
H2O + HCl + NaAlO2 → Al(OH)3 + NaCl
a a a (mol)
D. dung dịch X chứa NaOH dư do đó làm quỳ hóa xanh
Câu 2. Nhôm không tan trong dung dịch nào sau đây?
A. HCl.
B. H2SO4.
C. NaHSO4.
D. NH3.
Giải:
Phương trình phản ứng minh họa
2Al + 6HCl → 2AlCl3 + 3H2
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
2Al + 6NaHSO4 → 3Na2SO4 + Al2(SO4)3 + 3H2
Câu 3. Chất nào sau đây tác dụng với dung dịch NaAlO2 thu được kết tủa?
Giải:
Phương trình phản ứng minh họa
NaAlO2 + CO2 + 2H2O → Al(OH)3↓+ NaHCO3
NaAlO2 + HCl + H2O → NaCl + Al(OH)3↓
Al(OH)3 + 3HCl (dư) → AlCl3 + 3H2O
Câu 4. Cho 2,7 gam Al tan hoàn toàn trong dung dịch NaOH, sau phản ứng thu được V lít thoát ra. Giá trị của V ở điều kiện tiêu chuẩn là:
Giải:
nAl = 0,1 mol
Phương trình phản ứng hóa học
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
0,1 mol → 0,15 mol
VH2 = 0,15.22,4 = 3,36 lít
Câu 5. Rót 100ml dung dịch NaOH 3,5M vào 100 ml dung dịch AlCl3 1M thu được m gam kết tủa. Tính m?
Giải:
nNaOH= 0,35 mol
nAlCl3= 0,1 mol
Phương trình phản ứng hóa học
AlCl3+ 3NaOH → Al(OH)3 + 3NaCl
=> NaOH dư 0,05 mol. Tạo 0,1 mol Al(OH)3
Vì dư kiềm nên Al(OH)3 tan 1 phần
Al(OH)3 + NaOH → NaAlO2+ 2H2O
=> nAl(OH)3 tan= 0,05 mol
=> nAl(OH)3 dư= 0,1 – 0,05= 0,05 mol
=> mAl(OH)3 dư= 3,9g
Câu 6. Hòa tan m gam hỗn hợp X gồm Al và Na có tỉ lệ mol 1:2 vào nước dư thu được 4,48 lít khí (đktc). Giá trị của m là
Giải:
Gọi nAl = x (mol)
=> nNa = 2x (mol)
nH2 = 4,48 :22,4 = 0,2 (mol)
Phương trình phản ứng hóa học
Na + H2O → NaOH + 0,5H2↑
2x → x (mol)
Al + NaOH + H2O → NaAlO2 + 1,5H2↑
x → 1,5x (mol)
Vì Na : Al có tỉ lệ 1: 2 nên cả Na và Al cùng phản ứng hết
=> nH2 = x + 1,5x = 0,2
=> x = 0,08 (mol)
=> m = 0,08.27 + 2.0,08.23 = 5,84 (g)
Sau khi đọc xong bài viết của chúng tôi bạn có thể biết được Al + NAOH để vận dụng vào làm các bài tập từ cơ bản đến nâng cao nhanh chóng nhé