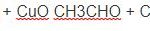Lý thuyết CH3CHO + AgNO3 + NH3+ H2O → CH3COONH4 + NH4NO3 + Ag và bài tập có đáp án
CH3CHO + AgNO3 + NH3+ H2O → CH3COONH4 + NH4NO3 + Ag là phản ứng oxi hóa anđehit đơn chức. Sau đây THPT Chuyên Lam Sơn sẽ giải thích anđehit axetic tác dụng với dung dịch AgNO3/NH3, sau phản ứng thu được kết tủa bạc. Mời các bạn tham khảo chi tiết nội dung dưới đây.
Tham khảo thêm:
Nội Dung
Phương trình phản ứng tráng gương của anđehit axetic:
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2NH4NO3 + 2Ag ↓
Điều kiện phản ứng xảy ra khi cho CH3CHO tác dụng AgNO3/NH3: Nhiệt độ thường
Hiện tượng khi cho anđehit axetic vào dung dịch chứa AgNO3 trong NH3: Hiện tượng là tạo kết tủa màu trắng xám của kim loại bạc, bám vào thành ống nghiệm, có thể soi gương được.
Tính chất vật lý của Andehit axetic – CH3CHO
Andehit axetic tồn tại ở trạng thái lỏng, trong suốt không màu, có mùi trái cây, hơi hăng, có độc tính.
Hợp chất này dễ bay hơi.
Có khả năng tan vô hạn trong nước.
Nhiệt độ sôi của ethanal: 20 độ C
Trong giới hạn nồng độ từ 4 – 57% thể tích, andehit axetic có thể tạo ra hỗn hợp nổ với không khí.
Tính chất hóa học của Andehit axetic – CH3CHO
+) Andehit axetic tác dụng với Cu(OH)2 và NaOH sinh ra Natri axetat, đồng I oxit và nước:
CH3CHO + 2CU(OH)2 + NaOH → CH3COONa + CU2O + 3H2O
+) Andehit axetic tác dụng với H2 tạo ra etanol:
CH3CHO + H2 → CH3CH2OH
+) Tác dụng với đồng (II) oxit, thu được sản phẩm là axit axetic, đồng (I) oxit và nước:
2CH3CHO + Cu(OH)2 → CH3COOH + Cu2O + 2H2O
+) Phản ứng tráng bạc (phản ứng đặc trưng nhất của andehit):
CH3CHO +4AgNO3 + 5NH3 → 4Ag + 3CH3COONH4 + 3NH4NO3
+) Andehit axetic phản ứng oxi hóa không hoàn toàn với O2 cho ra axit axetic:
CH3CHO + ½ O2 (xúc tác Mn2+ và nhiệt độ) → CH3COOH
Bài tập phản ứng CH3CHO + AgNO3
Câu 1. Nội dung nhận định nào sau đây là đúng?
A. Chỉ có anđehit mới tham gia phản ứng tráng bạc.
B. Cho x mol anđehit đơn chức tham gia phản ứng tráng bạc thì luôn thi được 2x mol Ag.
C. Các chất có công thức phân tử C2H4O2 đều tham gia phản ứng tráng bạc.
D. Axit fomic tham gia phản ứng tráng bạc
Giải:
Các hợp chất có nhóm CHO như CH3CHO, HO-CH2-CHO, HCOOCH3,…đều tham gia phản ứng tráng bạc
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2NH4NO3 + 2Ag ↓
3 HOCH2CHO + 8 AgNO3 + 12 NH3 + 2 H2O → 2 CH2(COONH4)2 + 8 Ag + 8 NH4NO3
HCOOCH3 + 2AgNO3 + 3NH3 + H2O → 2Ag + 2NH4NO3 + NH4OCOOCH3
Câu 2. Tiến hành thí nghiệm cho anđehit fomic vào dung dịch chứa AgNO3 trong NH3, hiện tượng sau phản ứng quan sát được là:
A. Tạo kết tủa màu trắng xám bám lên thành ống nghiệm
B. Tạo đồng thời kết tủa trắng và sủi bọt khí không màu
C. Có khí không màu thoát ra
D. Tạo kết tủa màu đen
Giải:
Phương trình phản ứng minh họa
HCHO + 2AgNO3 + 3NH3 + H2O→ HCOONH4 + 2Ag + 2NH4NO3
Hiện tượng là tạo kết tủa màu trắng xám của kim loại bạc, bám vào thành ống nghiệm, có thể soi gương được.
Câu 3. Cho 7,2 gam anđehit đơn chức X phản ứng hoàn toàn với một lượng dư Ag2O (hoặc AgNO3) trong dung dịch NH3 đun nóng, thu được m gam Ag. Hoà tan hoàn toàn m gam Ag bằng dung dịch HNO3 đặc, sinh ra 4,48 lít NO2 (sản phẩm khử duy nhất, ở đktc). Công thức của X là
Giải:
Phương trình phản ứng xảy ra
Ag + 2HNO3 → AgNO3 + NO2 + H2O
0,2 0,2
R-CHO → 2Ag
0,1 ← 0,2.
R+ 29 = 72 → R = 43 (C3H7)
Câu 4. Cho hỗn hợp khí X gồm HCHO và H2 đi qua ống sứ đựng bột Ni nung nóng. Sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Y gồm hai chất hữu cơ. Đốt cháy hết Y thì thu được 23,4 gam H2O và 15,68 lít khí CO2 (ở đktc). Phần trăm theo thể tích của H2trong X là
Giải:
nHCHO = nCO2 = 15,68/22,4 = 0,7 mol
nH2O = 1,3 mol
Đốt HCHO tạo nCO2 = nH2O => nH2 = nH2O – nCO2 = 1,3 – 0,7 = 0,6 mol
=> % VH2= 0,6/(0,6 + 0,7) = 46,15%
Câu 5. Phản ứng nào sau đây không tạo anđehit axetic?
A. Cho axetilen phản ứng với nước
B. Oxi hóa không hoàn toàn etilen
C. Oxi hóa không hoàn toàn ancol etylic
D. Oxi hóa không hoàn toàn ancol metylic
Giải:
Phương trình phản ứng minh họa
C2H2+ H2O → CH3CHO
2CH2=CH2 + O2 → 2CH3CHO
CH3CH2OH + CuO → CH3CHO + Cu + H2O
Sau khi đọc xong bài viết của chúng tôi bạn có thể biết được CH3CHO + AgNO3 để vận dụng vào làm các bài tập từ cơ bản đến nâng cao nhanh chóng nhé