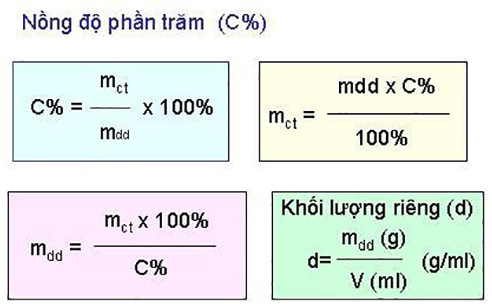
Liên kết cộng hóa trị là gì? Ý nghĩa liên kết cộng hóa trị và bài tập có lời giải chi tiết 100 %
Hóa học 10 mang đến cho các em nhiều kiến thức cơ bản làm nền tảng cho những bài học sau. Ở những bài học đầu tiên về liên kết hóa học, các em sẽ được học về liên kết cộng hóa trị. Vậy liên kết cộng hóa trị là gì và có những lưu ý gì khi học bài này, cùng tìm hiểu trong bài viết sau đây.
Tham khảo thêm:
- Phản ứng oxi hóa khử là gì? và các dạng bài tập từ cơ bản đến nâng cáo có lời giải
- Phenol là gì?Tính chất hóa học, công thức, cách điều chế phenol và các dạng bài tập
- Tính chất hóa học của muối và các dạng bài tập liên quan chuẩn 100%
Nội Dung
Liên kết cộng hóa trị là gì?
Liên kết ion, hay liên kết điện tích, là một liên kết hóa học có bản chất là lực hút tĩnh điện giữa hai ion mang điện tích trái dấu. Liên kết ion thường là liên kết giữa các nguyên tử nguyên tố phi kim với các nguyên tử nguyên tố kim loại.
Ví dụ về liên kết ion: Sự kết hợp giữa natri (Na+) và clorua (Cl–) tạo thành natri clorua (NaCl): Na+ + Cl– → NaCl
Xem ngay:
Sự tạo thành liên kết cộng hóa trị trong phân tử đơn chất
– Mỗi cặp electron chung tạo nên một liên kết cộng hóa trị.
– Các phân tử đơn chất tạo nên từ các nguyên tử của cùng một nguyên tố (có độ âm điện như nhau), nên các cặp electron chung không bị hút lệch về phía nguyên tử nào. Do đó, liên kết trong các phân tử đó không bị phân cực. Đó là liên kết cộng hóa trị không cực.
Sự tạo thành liên kết cộng hóa trị trong phân tử hợp chất
– Liên kết cộng hóa trị trong đó cặp electron chung bị lệch về phía nguyên tử có độ âm điện lớn hơn được gọi là liên kết cộng hóa trị có cực hay liên kết cộng hóa trị phân cực.
Công thức electron:
![]()
Công thức cấu tạo: N ≡ N
– Với những phân tử có cấu tạo thẳng như CO2: Liên kết giữa hai nguyên tử oxi và cacbon là phân cực, nhưng phân tử CO2 có cấu tạo thẳng nên độ phân cực của hai liên kết đôi (C=O) triệt tiêu nhau, kết quả là toàn bộ phân tử không bị phân cực.
– Liên kết cho – nhận:
+ Trong một số trường hợp, cặp electron chung chỉ do một nguyên tử đóng góp thì liên kết giữa hai nguyên tử là liên kết cho – nhận.
+ Điều kiện để có liên kết cho – nhận:
- Có nguyên tử còn dư một cặp electron chưa sử dụng.
- Có nguyên tử còn thiếu một cặp electron.
Tính chất của các chất có liên kết cộng hóa trị
– Các chất mà phân tử chỉ có liên kết cộng hóa trị có thể là chất rắn như đường, lưu huỳnh, iot, … có thể là chất lỏng: nước, ancol,… hoặc chất khí như khí cacbonic, clo, hiđro, …
– Các chất có cực như ancol etylic, đường, … tan nhiều trong dung môi có cực như nước.
– Phần lớn các chất không cực như iot, các chất hữu cơ không cực tan trong dung môi không cực như benzen, cacbon tetraclorua, …
– Nói chung, các chất chỉ có liên kết cộng hóa trị không cực không dẫn điện ở mọi trạng thái.
Liên kết cộng hóa trị và sự xen phủ các obitan nguyên tử
Sự xen phủ của các obitan nguyên tử khi hình thành các phân tử đơn chất
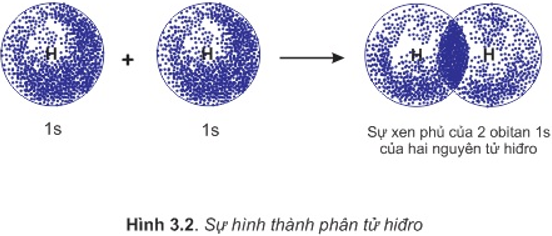
Sự hình thành phân tử H2
– Để hình thành liên kết giữa hai nguyên tử H trong phân tử hiđro, hai obitan 1s của hai nguyên tử H xen phủ với nhau tạo ra vùng xen phủ giữa hai hạt nhân nguyên tử.
– Ngoài lực đẩy tương hỗ giữa hai proton và hai electron còn có lực hút giữa các electron vơi hai hạt nhân hướng về tâm phân tử.
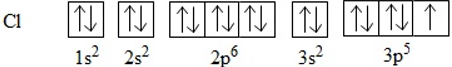
Sự hình thành phân tử Cl2
– Để giải thích sự hình thành liên kết Cl−Cl, có thể dựa vào cấu hình electron của mỗi nguyên tử clo:
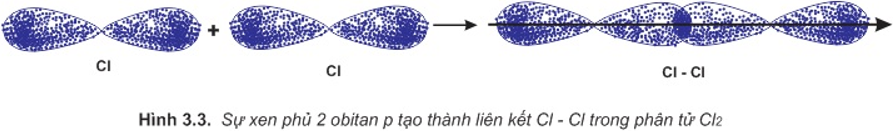
– Sự hình thành liên kết giữa hai nguyên tử clo là do sự xen phủ giữa hai obitan p chứa electron độc thân của mỗi nguyên tử clo:
Sự xen phủ của các obitan nguyên tử khi hình thành các phân tử hợp chất
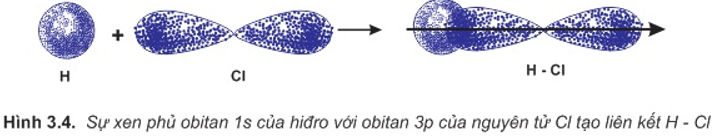
Sự hình thành phân tử HCl
– Liên kết hóa học trong phân tử hợp chất HCl được hình thành nhờ sự xenphủ giữa obitan 1s của nguyên tử hiđro và obitan 3p có 1 electron độc thân của nguyên tử clo.
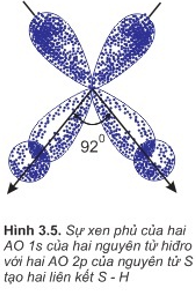
Sự hình thành phân tử H2S
Là sự xen phủ giữa obitan 1s của các nguyên tử hiđro và 2 obitan p của nguyên tử lưu huỳnh.
2 obitan p có 2 electron độc thân của nguyên tử S xen phủ với 2 obitan 1s có của 2 nguyên tử H tạo nên liên kết S−H.
Các dạng bài tập liên kết cộng hóa trị thường gặp
Bài 1. Số oxi hóa của nitơ trong NH4+, NO2– , và HNO3 lần lượt là:
Giải:
Đặt x, y, z lần lượt là số oxi hóa của nguyên tố nitơ trong NH4+, NO2– , và HNO3
Ta có: x + 4.1 = 1 ⇒ x = -3. Số OXH của N trong NH4+là -3
y + 2.(-2) = -1 ⇒ y = 3. Số OXH của N trong NO2– là +3
z + 1 + 3.(-2) = 0 ⇒ z = 5. Số OXH của N trong HNO3 là +5
Bài 2. Xác định số oxi hóa của các nguyên tố trong hợp chất , đơn chất và ion sau:
a) H2S, S, H2SO3, H2SO4.
b) HCl, HClO, NaClO2, HClO3.
c) Mn, MnCl2, MnO2, KMnO4.
Giải:
a) Số oxi hóa của S trong các chất lần lượt là: S-2, S0, S+4, S+6
b) Số oxi hóa của Cl trong các hợp chất: Cl-1, Cl+1,Cl+3, Cl+5, Cl+7.
c) Số oxi hóa của Mn trong các chất: Mn0, Mn+2, Mn+4, Mn+7
Bài 3: Có 2 nguyên tố X ( Z = 19); Y (Z =17) hợp chất tạo bởi X và Y có công thức và kiểu liên kết là:
Giải:
Cấu hình e:
X: [Ar]4s1 ⇒ X thuộc nhóm IA
Y: [Ne]3s23p5 ⇒ Y thuộc nhóm VIIA
Ta có: X – 1e → X+
Y + 1e → Y–
⇒ Hợp chất tạo bởi X và Y là XY và liên kết ion
Bài 4: Dựa vào hiệu độ âm điện các nguyên tố, hãy cho biết có loại liên kết nào trong các chất sau đậy: AlCl3, CaCl2, CaS, Al2S3?
Giải:
Hiệu độ âm điện:
CaCl2: 2,16. Liên kết ion
AlCl3: 1,55. Liên kết cộng hóa trị có cực
CaS: 1,58.Liên kết cộng hóa trị có cực.
Al2S3: 0,97. Liên kết cộng hóa trị có cực.
Bài 5 : X, A, Z là những nguyên tố có số điện tích hạt nhân là 9, 19, 8.
a) Viết cấu hình electron nguyên tử của các nguyên tố đó.
b) Dự đoán liên kết hóa học có thể có giữa các cặp X và A, A và Z, Z và X.
Giải:
a) 9X : 1s22s22p5 Đây là F có độ âm điện là 3,98.
19A : 1s22s22p63s23p64s1 Đây là K có độ âm điện là 0,82.
8Z: 1s22s22p4 Đây là O có độ âm điện là 3,44.
b) Cặp X và A, hiệu số độ âm điện là: 3,98 – 0,82 = 3,16, có liên kết ion.
Cặp A và Z, hiệu số độ âm điện là: 3,44 – 0,82 = 2,62, có liên kết ion.
Cặp X và Z, hiệu số độ âm điện là: 3,98 – 3,44 = 0,54, có liên kết cộng hóa trị có cực.
Mong rằng những nội dung trên đây sẽ giúp bạn trả lời được những thắc mắc câu hỏi của mình. Hơn hết đó là có thể giải được những bài toán của mình