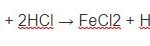Lý thuyến Fe + HCl → FeCl2 + H2 và bài tập có đáp án
Fe + HCl → FeCl2 + H2 là phản ứng oxi hóa khử. Chính vì thế nội dung tài liệu chúng tôi mang đến sẽ giúp các bạn học sinh trả lời nội dung câu hỏi Fe có tác dụng với HCl, sản phẩm sinh ra là muối sắt II và giải phóng khí hidro. Mời các bạn tham khảo
Tham khảo thêm:
- 8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3 + 9H2O
- NH4NO3 → N2O + 2H2O
- C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2Cu + H2O
Nội Dung
Phương trình Fe ra FeCl2
Fe + 2HCl → FeCl2 + H2
Điều kiện phản ứng Sắt tác dụng với axit clohidric: Nhiệt độ thường
Cách thực hiện phản ứng Fe tác dụng với HCl: Cho một ít kim loại Fe vào đáy ống nghiệm, nhỏ 1 – 2 ml dung dịch axit HCl vào ống nghiệm đã bỏ sẵn mẩu Fe.
Hiện tượng sau phản ứng Fe tác dụng với HCl:
- Kim loại bị tan dần, đồng thời có bọt khí không màu thoát ra
- Axit clohicđric là axit mạnh, có khả năng tác dụng với kim loại đứng trước hidro. Và khi cho Fe tác dụng với axit HCl chỉ cho muối sắt (II)
Tính chất vật lí của Sắt:
+) Màu trắng hơi xám, dẻo, dễ rèn, dễ dát mỏng, kéo sợi; dẫn nhiệt và dẫn điện kém đồng và nhôm.
+) Sắt có tính nhiễm từ nhưng ở nhiệt độ cao (8000C) sắt mất từ tính. t0nc = 15400C.
+) Sắt là kim loại nặng, khối lượng riêng D = 7,86g/cm3
Trạng thái tự nhiên của Sắt
Là kim loại phổ biến sau nhôm, tồn tại chủ yếu ở các dạng:
+) Hợp chất: oxit, sunfua, silicat…
+) Quặng: hematit đỏ (Fe2O3 khan), hematit nâu (Fe2O3.nH2O), manhetit (Fe3O4), xiđerit (FeCO3) và pirit (FeS2).
Tính chất hóa học của sắt
Tác dụng với phi kim
+) Với oxi: 3Fe + 2O2 Fe3O4
+) Với clo: 2Fe + 3Cl2 2FeCl3
+) Với lưu huỳnh: Fe + S FeS
⇒ Ở nhiệt độ cao, sắt phản ứng được với nhiều phi kim.
Tác dụng với dung dịch axit
+) Tác dụng với với HCl, H2SO4 loãng
Fe + 2HCl → FeCl2 + H2
+) Tác dụng với H2SO4 đặc, nóng; HNO3 đặc:
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
Không tác dụng với H2SO4 đặc nguội, HNO3 đặc, nguội
Tác dụng với dung dịch muối
+) Đẩy được kim loại yếu hơn ra khỏi muối
Fe + CuSO4 → FeSO4 + Cu
Bài tập phản ứng Fe + HCl
Câu 1. Chỉ sử dụng một hóa chất duy nhất, nhận biết 4 dung dịch mất nhãn sau: KNO3, Cu(NO3)2, AgNO3, Fe(NO3)3. Dung dịch đó là:
Giải:
Trích mẫu thử và đánh số thứ tự
Sử dụng dung dịch NaOH để nhận biết
Mẫu thử nào xuất hiện kết tủa xanh, chất ban đầu là Cu(NO3)2
NaOH + Cu(NO3)2 → NaNO3 + Cu(OH)2
Mẫu thử nào xuất hiện kết tủa đỏ nâu thì chất ban đầu là Fe(NO3)3
Fe(NO3)3+ 3NaOH → Fe(OH)3 + 3NaNO3
Mẫu thử nào xuất hiện kết tủa trắng sau đó hóa đen, thì chất ban đầu là AgNO3
AgNO3 + NaOH → AgOH + NaNO3
AgOH → Ag2O + H2O
Dung dịch không có hiện tượng gì là KNO3
Câu 2. Khử m gam Fe3O4 bằng khí H2 thu được hổn hợp X gồm Fe và FeO, hỗn hợp X tác dụng vừa hết với 1,5 lít dung dịch H2SO4 0,2M (loãng). Giá trị của m là
Giải:
Theo bài ra, xác định được sau phản ứng chỉ thu được FeSO4
→ nFeSO4 = nSO42- = naxit = 0,3 mol.
Bảo toàn nguyên tố Fe → nFe3O4 = 0,3 : 3 = 0,1 mol
→ m = 0,1.232 = 23,2 gam.
Câu 3. Khi điều chế FeCl2 bằng cách cho Fe tác dụng với dung dịch HCl. Để bảo quản dung dịch FeCl2 thu được không bị chuyển thành hợp chất sắt (III), người ta có thể cho thêm vào dung dịch
Giải:
Dung dịch FeCl2dễ bị không khí oxi hóa thành muối Fe3+. Để bảo quản FeCl2 người ta thêm 1 lương Fe vì: Fe + 2Fe3+ → 3Fe2+
Không dùng HNO3 vì HNO3 oxi hóa luôn ion Fe2+ thành Fe3+,
Không dùng Zn sẽ tạo ra 1 lượng muối Zn2+,
Không dùng HCl sẽ không ngăn cản quá trình tạo Fe3+.
Câu 4. Hòa tan 10 gam hỗn hợp bột Fe và Fe2O3 bằng một lượng dung dịch HCl vừa đủ, thu được 1,12 lít hidro (đktc) và dd X. Cho dd X tác dụng với dd NaOH lấy dư. Lấy kết tủa thu được đem nung nóng trong không khí đến khối lượng không đổi thu được chất rắn Y. Khối lượng chất rắn Y là:
Giải:
nH2(đktc) = 1,12: 22,4 = 0,05 (mol)
Phương trình hóa học:
Fe + 2HCl → FeCl2 + H2↑ (1)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O (2)
Theo phương trình hóa học (1): nFe = nH2 = 0,05 (mol) → mFe = 0,05×56 = 2,8 (g)
→ mFe2O3 = mhh – mFe = 10 – 2,8 =7,2 (g) → nFe2O3 = 7,2 : 160 = 0,045 (mol)
Theo phương trình hóa học (1): nFeCl2 = nFe = 0,05 (mol)
Theo phương trình hóa học (2): nFeCl3 = 2nFe2O3 = 2.0,05 = 0,1 (mol)
dung dịch X thu được chứa: FeCl2: 0,05 (mol) và FeCl3: 0,1 (mol)
FeCl2 + 2NaOH → Fe(OH)2 + NaCl
FeCl3 + 3NaOH → Fe(OH)3 + NaCl
Kết tủa thu được Fe(OH)2 và Fe(OH)3
Nung 2 kết tủa này thu được Fe2O3
BTNT “Fe”: 2nFe2O3 = nFeCl2 + nFeCl3 → nFe2O3 = (0,05 + 0,1)/2 = 0,075 (mol)
→ mFe2O3 = 0,075 × 160 = 12 (g)
Câu 5. Cho 8,85 gam hỗn hợp X gồm Al, Mg tác dụng với dung dịch HCl dư, thu được 8,96 lít H2 (đktc). Thành phần phần trăm khối lượng của Al trong X là
Giải:
nH2 = 0,3 mol
Bảo toàn electron
3nAl + 2nMg = 2nH2 ⇒ 3nAl + 2nMg = 0,85 (1)
mhh = 27nAl + 24nMg = 8,85 (2)
Giải hệ (1) và (2) ⇒ nAl = 0,15 (mol); nMg = 0,2 mol
⇒ %mAl = 0,15.27/8,85 .100% = 45,76%
Sau khi đọc xong bài viết của chúng tôi bạn có thể biết được Fe + HCl để vận dụng vào làm các bài tập từ cơ bản đến nâng cao nhanh chóng nhé