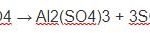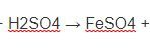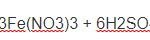Lý thuyết S + H2SO4 → SO2 + H2O và bài tập có đáp án
S + H2SO4 → SO2 + H2O là phản ứng hóa học thể hiện tính khử của huỳnh với axit sunfuric thường xuất hiện trong nội dung các bài học Hóa học 10 đã đượcTHPT Chuyên Lam Sơn giải đáp chi tiết trong bài viết dưới đây
Tham khảo thêm:
- C2H4 + H2O → C2H5OH: Lý thuyết và bài tập có đáp án
- C2H5OH → C2H4 + H2O: Lý thuyết và bài tập có đáp án
- C2H5OH + O2 → CH3COOH + H2O: Lý thuyết và bài tập có đáp án
Nội Dung
Phương trình phản ứng H2SO4 ra SO2:
S + 2H2SO4 → 3SO2 + 2H2O
Điều kiện để S tác dụng với H2SO4 tạo ra SO2: Nhỏ từ từ H2SO4 đặc vào ống nghiệm đựng sẵn bột lưu huỳnh
Hiện tượng phản ứng khi tiến hành H2SO4 ra SO2
Chất rắn màu vàng Lưu huỳnh (S) tan dần và xuất hiện khí mùi hắc Lưu huỳnh dioxit (SO2) làm sủi bọt khí, các bạn học sinh phải hết lưu ý SO2 là một khí độc do đó trong quá trình làm thí nghiệm cần dùng bông tẩm kiềm tránh khí SO2 thoát ra ngoài.
Tính chất hóa học của lưu huỳnh
Nguyên tử S có 6e lớp ngoài cùng, trong đó có 2e độc thân.
– Khi tham gia phản ứng hóa học, số oxi hóa của lưu huỳnh có thể giảm hoặc tăng: −2; 0; +4; +6.
⟹ Lưu huỳnh có tính oxi hóa và tính khử.
Lưu huỳnh có tính oxi hóa
Khi lưu huỳnh tác dụng với kim loại hoặc hiđro, số oxi hóa của lưu huỳnh từ 0 giảm xuống −2
S0 + 2e → S-2
S thể hiện tính oxi hóa khi tác dụng với kim loại và hidro.
+) Tác dụng với hiđro:
H2 + S → H2S (350oC)
Lưu huỳnh tác dụng với khí hiđro tạo thành khí hiđro sunfua.
+) Tác dụng với kim loại(có to, tạo sản phẩm có số oxh thấp của kim loại).
Fe + S → FeS
Zn + S → ZnS
Hg + S → HgS
(Thủy phân sunfua, phản ứng xảy ra ở nhiệt độ thường nên thường dùng S khử độc Hg)
Chú ý: Một số muối sunfua có màu đặc trưng: CuS, PbS, Ag2S (màu đen); MnS (màu hồng); CdS (màu vàng) → thường được dùng để nhận biết gốc sunfua.
– Muối sunfua được chia thành 3 loại:
- Loại 1. Tan trong nước gồm Na2S, K2S, CaS và BaS, (NH4)2S.
- Loại 2. Không tan trong nước nhưng tan trong axit mạnh gồm FeS, ZnS, …
- Loại 3. Không tan trong nước và không tan trong axit gồm CuS, PbS, HgS, Ag2S, …
Lưu huỳnh có tính khử
Khi lưu huỳnh phản ứng với phi kim hoạt động mạnh hơn, số oxi hóa của lưu huỳnh từ 0 tăng lên +4 hoặc +6.
S → S+4 + 4e
S → S+6 + 6e
+) Tác dụng với phi kim
S thể hiện tính khử khi tác dụng với 1 số phi kim và 1 số hợp chất có tính oxi hóa.
+) Tác dụng với oxi:
S + O2 →SO2
S + F2 →SF6
+) Tác dụng với các chất có tính oxi hóa mạnh (H2SO4, HNO3,…)
S + H2SO4 đặc → 3SO2 + 2H2O
S + 4HNO3 đặc → 2H2O + 4NO2 + SO2
Bài tập phản ứng H2SO4ra SO2:
Câu 1. Hơi thủy ngân rất độc, do đó nếu khi ta vô tình đánh rơi vỡ nhiệt kế thì chất bột được dùng để rắc lên thủy ngân rồi gom lại là:
A. Bột lưu huỳnh
B. Cát
C. Muối ăn
D. Vôi bột
Giải:
Thủy ngân tác dụng với lưu huỳnh ngay tại điều kiện thường:
Hg + S → HgS ↓
Do đó khi làm vỡ nhiệt kế thuỷ ngân thì chất bột được dùng để rắc lên thuỷ ngân rồi gom lại là lưu huỳnh.
Câu 2. Số hiệu nguyên tử của lưu huỳnh là 16. Cho biết vị trí của lưu huỳnh trong bảng tuần hoàn các nguyên tố hóa học?
Giải:
Cấu hình electron nguyên tử S là: 1s22s22p63s23p4.
→ Lưu huỳnh ở chu kỳ 3 (do có 3 lớp electron); nhóm VIA (do có 6 electron hóa trị, nguyên tố p).
Câu 3. Dãy chất nào trong các dãy sau đây gồm các chất đều thể hiện tính oxi hóa khi phản ứng với SO2?
Giải:
Dãy chất đều thể hiện tính oxi hóa khi phản ứng với SO2 là:
O2 + 2SO2 → 2SO3
Br2 + H2O + SO2 → 2HBr + H2SO4
2KMnO4 + 2H2O + 5SO2 → K2SO4 + 2MnSO4 + 2H2SO4
Câu 4. Đun nóng 20 gam một hỗn hợp X gồm Fe và S trong điều kiện không có không khí thu được hỗn hợp rắn A. Hòa tan hỗn hợp rắn A vào dung dịch HCl thu được 6,72 lít (đktc) hỗn hợp khí Y. Thành phần phần trăm khối lượng Fe trong X là
Giải:
Fe + S → FeS
FeS + 2HCl → FeCl2 + H2S;
Fe + 2HCl → FeCl2 + H2
nFe(bđ) = nFeS + nFe(dư) = nH2S + nH2 = 6,72/22,4 = 0,3 (mol)
%mFe = 0,3.56/20.100% = 84%
Câu 5. Đốt cháy hoàn toàn m gam FeS2 bằng một lượng O2 vừa đủ, thu được khí X. Hấp thị hết X vào 2 lít dung dịch chứa Ba(OH)2 0,1M, thu được dung dịch Y và 21,7 gam kết tủa. Cho Y vào dung dịch NaOH, thấy xuất hiện thêm kết tủa. Giá trị của m là
Giải:
nBa(OH)2= 0,1.2 = 0,2 (mol); nBaSO3 = 21,7/217 = 0,1 (mol)
nBaSO3= 2nBa(OH)2 – nSO2 ⇒ nSO2 = 2.0,2 – 0,1 = 0,3 (mol)
2nFeS2= 2nSO2 ⇒ nFeS2 = 0,15 (mol) ⇒ mFeS2= 0,15.120 = 18 (gam)
Câu 6 Nung nóng 13,1 gam một hỗn hợp gồm Mg, Zn, Al trong không khí đến phản ứng hoàn toàn thu được 20,3 gam hỗn hợp gồm MgO, ZnO, Al2O3 Hoà tan 20,3 gam hỗn hợp oxit trên cần dùng V lít dung dịch HCl 0,4M. Tính khối lượng muối clorua tạo ra.
Giải:
Ta có sơ đồ chuyển hoá :
Mg, Zn, Al → O2 MgO, ZnO, Al2O3
MgO + 2HCl → MgCl2 + H2O
ZnO + 2HCl → ZnCl2 + H2O
Al2O3 + 6HCl → 2AlCl3 + 3H2O
MgO, ZnO, Al2O3 → HCl, MgCl2, ZnCl2, AlCl3
Bảo toàn khối lượng: moxit + mHCl = mmuối + mH2O
⇒ 20,3 + 0,9.36,5 = mmuối + 0,45.18
⇒ mmuối = 45,05 g
THPT Chuyên Lam Sơn đã gửi tới bạn phương trình hóa học S + H2SO4 → SO2 + H2O. Với phương trình hóa học này, các em lưu ý sản phẩm sinh ra, để viết và cân bằng phương trình một cách nhanh và chính xác nhất.