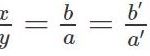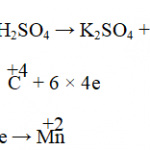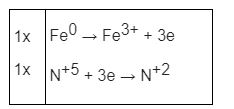Dãy Điện Hóa là gì ? Cách đọc Dãy Điện Hõa kim loại dễ thuộc
bạn đang tìm hiểu về dãy điện hóa, hay đang tìm hiểu về mẹo học dãy điện hóa kim loại dễ nhớ, dễ thuộc một cách khoa học.
Mời các bạn tham khảo thông tin bên dưới đây để hiểu hơn về dãy điện hóa kim loại là gì ? Có những thành phần gì , cách đọc dãy điện hóa kim loại như thế nào là chính xác nhớ lâu.
Nội Dung
Dãy điện hóa kim loại là gì ?
+ Dãy điện hóa chính là dãy hoạt động hóa học của kim loại có ý nghĩa, vai trò quan trọng trong sự phát triển của lĩnh vực hóa học.
+ Dãy hoạt động hóa học của kim loại gồm dãy các kim loại được sắp xếp theo thứ tự, thứ tự này phụ thuộc vào mức độ hoạt động của kim loại (tức là khả năng tham gia phản ứng hóa học với chất khác).
Dãy điện hóa của kim loại
+ Dạng oxi hóa và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hóa khử của kim loại. Ví dụ: Ag+/Ag ; Cu2+/ Cu
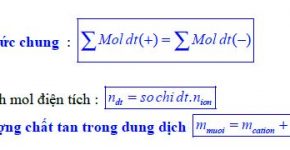
+ Các kim loại trong dãy điện hoá được sắp xếp theo chiều tính khử của kim loại giảm dần và tính oxi hoá của ion kim loại tăng dần.
+ Dãy điện hoá cho phép dự đoán chiều của phản ứng giữa hai cặp oxi hoá – khử: chất oxi hoá mạnh hơn sẽ oxi hoá chất khử mạnh hơn sinh ra chất oxi hoá yếu hơn và chất khử yếu hơn.
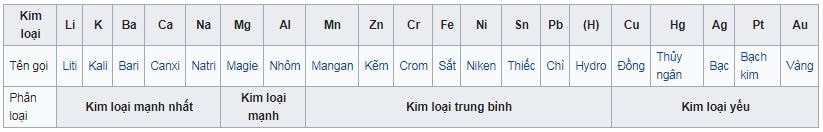
Bảng dãy điện hóa kim loại
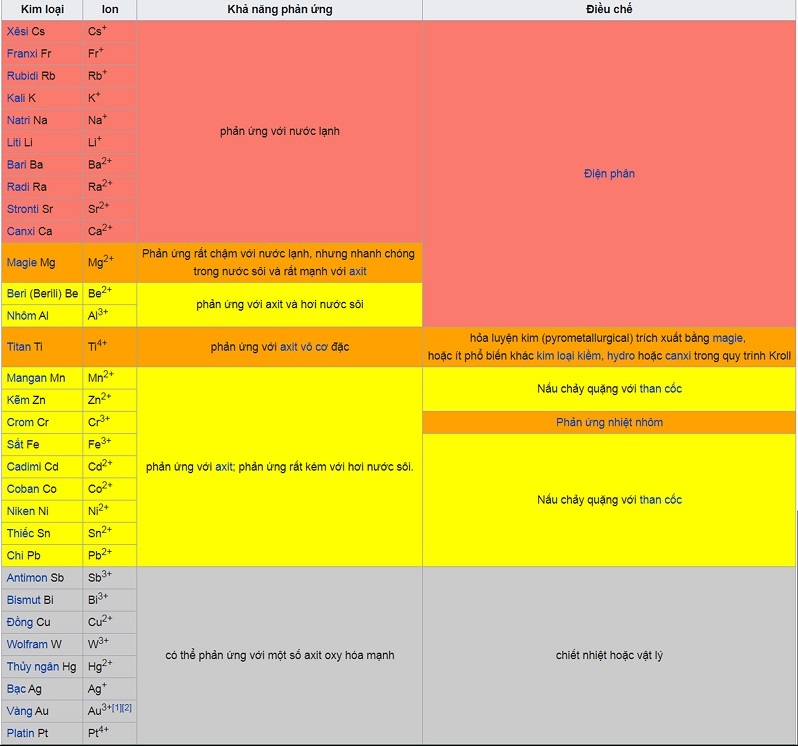
Đi từ dưới lên trên cùng của bảng kim loại:
- Khả năng phản ứng tăng;
- Khả năng cho electron (bị oxy hóa) dễ dàng hơn để tạo thành các ion dương;
- Ăn mòn hoặc xỉn màu dễ hơn;
- Cần nhiều năng lượng hơn (và các phương pháp khác nhau) để được tách chúng từ các hợp chất của chúng;
- Trở thành chất khử mạnh hơn.
Ý nghĩa của dãy điện hoá của kim loại
+ Dãy điện hoá của kim loại cho phép dự đoán chiều của phản ứng giữa 2 cặp oxi hoá – khử theo quy tắc anpha: Phản ứng giữa 2 cặp oxi hoá – khử sẽ xảy ra theo chiều chất oxi hoá mạnh hơn sẽ oxi hoá chất khử mạnh hơn, sinh ra chất oxi hoá yêu hơn và chất khử yếu hơn.
Tính chất hóa học của kim loại
1. Tính chất vật lý
– Tính dẻo: do các ion dương trong mang tinh thể kim loại có thể trượt lên nhau một cách dễ dàng mà không bị tạch khỏi nhau nhờ các electron tự do.
– Tính dẫn điện: Khi đặt một hiệu điện thế vào hai đầu dây kim loại , nhưng electron chuyển động tự do sẽ chuyển động thành dòng có hướn từ âm đến dương.
– Tính dẫn nhiệt: do có các electron tự do trong mạng tinh thể.
– Ánh kim: các electron tự do trong mạng tinh thể phản xạ hầu hết những tia sáng nhìn thấy được
=>Tính chất vật chung của kim loại do các electron tự do trong mạng tinh thể kim loại.
2. Tính chất hóa học của kim loại
+ Tính chất hoá học chung là tính khử.
M → Mn+ +ne (1 ≤ n ≤ 3)
+ Tác dụng với phi kim
Tác dụng với clo: 2Fe + Cl2 →(to) 2FeCl3
Tác dụng với oxi: 4Al + O2 →(to) 2Al2O3
Tác dụng với lưu huỳnh: Hg + S →(to) HgS
+ Tác dụng với dung dịch axit
Dung dịch HCl, H2SO4 loãng : kim loại khử H+ thành H2
Ví dụ: Fe + 2HCl → FeCl2 + H2
Dung dịch HNO3, H2SO4 đặc: kim loại khử N+5, S+6 xuống số oxi hóa thấp hơn
Ví dụ: 3Cu + HNO3 loãng → 3CuSO4 + 2NO↑ + 4H2O
Tác dụng với nước: kim loại nhóm IA và IIA
Ví dụ: 2Na + 2H2O → 2NaOH + H2↑
+ Tác dụng với dung dịch muối
Kim loại mạnh hơn khử ion kim loại yếu hơn trong muối thành kim loại tự do:
Ví dụ: Fe + CuSO4 → FeSO4 + Cu
Xem thêm