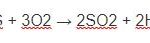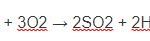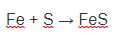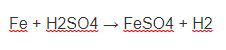2FeCl2 + Cl2 → 2FeCl3: Lý thuyết và bài tập có đáp án
FeCl2 + Cl2 → FeCl3 là phương trình phản ứng FeCl2 tạo ra FeCl3, khi cho FeCl2 tác dụng với Cl2. Hy vọng tài liệu mà THPT Chuyên Lam Sơn sẽ giúp ích cho các bạn học sinh trong quá trình học tập cũng như làm các dạng bài tập liên quan.
Tham khảo thêm:
- NO2 + O2 + H2O → HNO3: Lý thuyết và bài tập có đáp án
- C2H5OH + O2 → CH3COOH + H2O: Lý thuyết và bài tập có đáp án
- C2H5OH → C2H4 + H2O: Lý thuyết và bài tập có đáp án
Nội Dung
Phương trình phản ứng FeCl2 ra FeCl3:
2FeCl2 + Cl2 → 2FeCl3
Điều kiện phản ứng FeCl2 ra FeCl3: Nhiệt độ thường
Hiện tượng sau phản ứng FeCl2 tác dụng Cl2:
Khí màu vàng clo (Cl2) tan dần trong dung dịch Sắt II clorua (FeCl2) màu xanh lam nhạt và chuyển thành màu nâu đỏ của dung dịch Sắt III clorua (FeCl3).
Muối sắt (II) clorua
Sắt(II) clorua là tên gọi để chỉ một hợp chất được tạo bởi sắt và 2 nguyên ử clo. Thường thu được ở dạng chất rắn khan. Công thức phân tử: FeCl2
Tính chất vật lí và nhận biết của muối sắt clrua
Tính chất vật lý: Nó là một chất rắn thuận từ có nhiệt độ nóng chảy cao, và thường thu được dưới dạng chất rắn màu trắng. Tinh thể dạng khan có màu trắng hoặc xám; dạng ngậm nước FeCl2.4H2O có màu xanh nhạt.
Trong không khí, dễ bị chảy rữa và bị oxi hoá thành sắt (III).
Nhận biết: Sử dụng dung dịch AgNO3, thấy xuất hiện kết tủa trắng.
FeCl2+ 2AgNO3 → Fe(NO3)2 + 2AgCl↓
Tính chất hóa học của muối sắt clrua
Mang đầy đủ tính chất hóa học của muối.
Có tính khử Fe2+ → Fe3+ + 1e
- Tác dụng với dung dịch kiềm: FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
- Tác dụng với muối: FeCl2 + 2AgNO3 → Fe(NO3)2 + 2AgCl
Tính khử:
Thể hiện tính khử khi tác dụng với các chất oxi hóa mạnh: 2FeCl2 + Cl2 → 2FeCl3
Cách điều chế muối sắt clorua
Cho kim loại Fe tác dụng với axit HCl: Fe + 2HCl → FeCl2+ H2
Cho sắt (II) oxit tác dụng với HCl: FeO + 2HCl → FeCl2 + H2O
Bài tập phản ứng FeCl2 ra FeCl3
Câu 1. Thực hiện các thí nghiệm sau:
(1) Đốt dây sắt trong bình khí clo dư
(2) Cho Fe vào dung dịch HNO3 đặc, nguội
(3) Cho Fe vào dung dịch HCl loãng, dư
(4) Cho Fe vào dung dịch Cu(NO3)2
(5) Cho Fe vào dung dịch H2SO4 đặc, nóng
Số thí nghiệm tạo ra muối Fe(II) là:
Giải;
Thực hiện các thí nghiệm sau:
(1) Đốt dây sắt trong bình khí clo dư
Fe + 3Cl2 → 2FeCl3
(2) Cho Fe vào dung dịch HNO3 đặc, nguội
Không xảy ra phản ứng vì Fe bị thụ động trong HNO3 đặc nguội
(3) Cho Fe vào dung dịch HCl loãng, dư
Fe + 2HCl → FeCl2 + H2
(4) Cho Fe vào dung dịch Cu(NO3)2
3 Cu(NO3)2 + 2 Fe → 3 Cu + 2 Fe(NO3)3
(5) Cho Fe vào dung dịch H2SO4 đặc, nóng
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O
Câu 2. Để nhận biết 3 lọ mất nhãn đựng 3 dung dịch CuCl2, FeCl3, MgCl2 ta dùng gì?
Giải:
Có thể nhận biết một số cation trên dựa vào màu sắc đặc trưng của chúng
Để nhận biết 3 lọ mất nhãn đựng 3 dung dịch muối CuCl2, FeCl3, MgCl2 ta dùng dung dịch NaOH vì tạo các kết tủa có màu khác nhau:
Dung dịch CuCl2 tạo kết tủa xanh: CuCl2 + 2NaOH → Cu(OH)2↓xanh + 2NaCl
Dung dịch FeCl3 tạo kết tủa đỏ nâu: FeCl3 + 3NaOH → Fe(OH)3 ↓đỏ nâu + 3NaCl
Dung dịch MgCl2 tạo kết tủa trắng: MgCl2 + 2NaOH → Mg(OH)2 ↓trắng + 3NaCl
Câu 3. Hòa tan Fe3O4 vào dung dịch HCl được dung dịch X. Chia X làm 3 phần:
Thêm KOH dư vào phần 1 được kết tủa Y. Lấy Y để ngoài không khí.
Cho bột Cu vào phần 2.
Sục Cl2 vào phần 3.
Trong các quá trình trên có số phản ứng oxi hoá – khử là
Giải;
Fe3O4 + 8HCl → FeCl2 + 2FeCl3+ 4H2O (1)
Phần 1:
FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl (2)
FeCl3+ 3NaOH → Fe(OH)3 + 3NaCl (3)
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3 (4)
Phần 2:
2FeCl3 + Cu → 2FeCl2 + CuCl2 (5)
Phần 3:
2FeCl2 + Cl2 → 2FeCl3 (6)
Các phản ứng oxi hóa khử là : (4), (5), (6).
Câu 4. Cho m gam Mg vào dung dịch chứa 0,18 mol FeCl3. Sau khi phản ứng xảy ra hoàn toàn thu được 6,72 gam chất rắn. Giá trị của m là
Giải:
Nếu Mg dư hoặc vừa đủ:
mchất rắn = mFe+ mMg (dư)≥ nFe = 0,18.56 = 10,08 gam
mà chỉ thua được 6,72 gam chất rắn nên Mg phản ứng hết → nFe = 0,12 mol.
Mg (0,09) + 2Fe3+ (0,18 mol) → Mg2+ + 2Fe2+
Mg (0,12) + Fe2+ → Mg2+ (0,12 mol) + Fe
→ nMg = 0,09 + 0,12 = 0,21 mol → mMg= 0,21.24 = 5,04 gam.
Câu 5. Hòa tan hoàn toàn hỗn hợp Mg và Fe trong dung dịch HCl 2M thu được khí H2 (đktc) và dung dịch D. Để kết tủa hoàn toàn các ion trong D cần 150 ml dung dịch NaOH 2M. Thể tích dung dịch HCl đã dùng là
Giải:
Áp dụng định luật bảo toàn nguyên tố Natri
nNaCl = nNaOH = 0,3 (mol)
Áp dụng định luật bảo toàn nguyên tố Clo
=> nHCl= nNaCl = 0,3 (mol)
VHCl = 0,3 : 2 = 0,15 lít
Câu 6. Kim loại được dùng để làm sạch FeSO4 có lẫn tạp chất là CuSO4 là?
Giải:
Kim loại được dùng để làm sạch dung dịch FeSO4 có lẫn tạp chất là CuSO4 là Fe
Sử dụng một lượng dư kim loại Fe
Fe + CuSO4 → FeSO4 + Cu
Lọc bỏ kim loại thu được dung dịch FeSO4 tinh khiết.
Câu 7. Sử dụng hóa chất nào sau đây để nhận biết 4 dung dịch mất nhãn sau: KNO3, Cu(NO3)2, AgNO3, Fe(NO3)3
Giải:
KNO3, Cu(NO3)2, AgNO3, Fe(NO3)3
Trích mẫu thử và đánh số thứ tự
Sử dụng dung dịch NaOH để nhận biết
Mẫu thử nào xuất hiện kết tủa xanh, chất ban đầu là Cu(NO3)2
NaOH + Cu(NO3)2 → NaNO3 + Cu(OH)2
Mẫu thử nào xuất hiện kết tủa đỏ nâu thì chất ban đầu là Fe(NO3)3
Fe(NO3)3 + 3NaOH → Fe(OH)3 + 3NaNO3
Mẫu thử nào xuất hiện kết tủa trắng sau đó hóa đen, thì chất ban đầu là AgNO3
AgNO3 + NaOH → AgOH + NaNO3
AgOH → Ag2O + H2O
Dung dịch không có hiện tượng gì là KNO3
Mong rằng những nội dung trên đây sẽ giúp bạn trả lời được những thắc mắc câu hỏi của mình. Hơn hết đó là có thể giải được những bài toán của mình