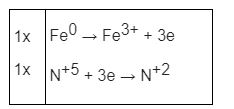Lý thuyết Fe + S → FeS và bài tập có đáp án
Fe + S → FeS được THPT Chuyên Lam Sơn biên soạn là phương trình phản ứng hóa học thể hiện tính oxi hóa của lưu huỳnh khi cho tác dụng với kim loại, và phương trình phản ứng được viết ở đây là cho Lưu huỳnh tác dụng kim loại Fe đun nóng.
Tham khảo thêm:
Nội Dung
Phương trình phản ứng giữa Fe và FeS
Fe + S → FeS
Điều kiện phản ứng Fe và FeS: Nhiệt độ cao
Cách thực hiện phản ứng Fe và FeS: Cho kim loại sắt tác dụng với bột lưu huỳnh rồi đốt nóng hỗn hợp.
Hiện tượng nhận biết phản ứng Fe và FeS:
Khi đốt nóng hỗn hợp, lưu huỳnh nóng chảy, hỗn hợp cháy sáng và bắt đầu chuyển thành hợp chất màu đen, phản ứng tỏa nhiều nhiệt.
Tính chất hóa học của lưu huỳnh
Thể hiện tính oxi hóa
+) Tác dụng với kim loại.: Thuỷ ngân phản ứng với lưu huỳnh ở ngay nhiệt độ thường:
Hg + S → HgS
Tác dụng với hidro: Lưu huỳnh cũng phản ứng trực tiếp với hiđro. Khi dẫn hiđro vào ống nghiệm đứng lưu huỳnh đang sôi thì ở đầu ống dẫn khí xuất hiện khí mùi trứng thối, đó là hiđro sunfua:
H2 + S → H2S
Thể hiện tính khử
+) Lưu huỳnh tác dụng hầu như với tất cả các phi kim, trừ nitơ và iot.
S + O2 → SO2
+) Tác dụng với các chất oxi hóa khác
3S + 2KClO3 → 2KCl + 3SO2
S + 6HNO3 (đặc) → H2SO4 + 6NO2 + 2H2O
Bài tập phản ứng Fe + S
Câu 1: Hòa tan hoàn toàn m gam hỗn hợp X gồm Fe và FeS trong dung dịch HCl dư thu được dung dịch Y và thoát ra 4,928 lít hỗn hợp khí Z. Cho hỗn hợp khí Z qua dung dịch Pb(NO3)2 dư thu được 47,8 gam kết tủa đen. Thành phần phần trăm về khối lượng của FeS trong hỗn hợp X là bao nhiêu?
Giải:
– Theo định luật bảo toàn nguyên tố S, ta có: nFeS = nH2S = nPbS = 47,8/239 = 0,2(mol).
– Ta có: nZ = nH2 + nH2S = 4 ,982/22,4 = 0,22(mol).
⇒ nH2 = 0,22 – 0,2 = 0,002 (mol).
– Theo định luật bảo toàn electron (số electron nhường = số electron nhận) thì: nFe = nH2 = 0,02(mol).
⇒ %mFeS ≈94,02%
Câu 2 Nung 5,6 gam bột sắtt và 13 gam kẽm với một lượng dư bột lưu huỳnh, sau phản ứng thu được rắn X. Hòa tan hoàn toàn X trong dung dịch axit clohidric thu được khí Y. Dẫn khí Y vào V lit dung dịch CuSO4 dư, sau phản ứng hoàn toàn thu được m gam kết tủa. Tính giá trị của m?
Giải:
– Ta có: nFe = 5,6/56 = 0,1(mol); nZn = 13/65 = 0,2(mol);
Fe + S → FeS
Zn + S → ZnS
FeS + HCl → FeCl2 + H2S
ZnS + HCl → ZnCl2 + H2S
H2S + CuSO4 → CuS + H2SO4
– Theo PTPƯ ta có: nCuS = nH2S = nFeS + nZnS = nFe + nZn = 0,1 + 0,2 = 0,3(mol).
⇒ mCuS = 0,3.96 = 28,8(g).
Câu 3: Cho 10,4 gam hỗn hợp X gồm Fe, S, FeS, FeS2 tác dụng với dung dịch HNO3 đặc nóng dư thu được V lít khí NO2 (là sản phẩm khử duy nhất đo ở ĐKTC) và dung dịch A. Cho A tác dụng với dung dịch Ba(OH)2 dư thu được 45,65g kết tủa. Tìm giá trị của V?
Giải:
– Theo bài ta, 10,4 gam hỗn hợp, ta có: mhh = 56x + 32y = 10,4 (*)
– Thu được 45,65 gam kết tủa là Fe(OH)3 và BaSO4 , ta có: 107x + 233y = 45,65 (**)
– Giải hệ (*) và (**) ta được: x = 0,1 và y = 0,15(mol).
– Theo định luật bảo toàn e, thì ta có: 3nFe + 6nS = nNO2 ⇒ nNO2 = 3.0,1+6.0,15 = 1,2(mol).
⇒ V = 1,2.22,4 = 26,88(lít).
Câu 4: Đem nung nóng hỗn hợp A gồm 2 kim loại: x mol Fe và 0,15 mol Cu trong không khí một thời gian thu được 63,2g hỗn hợp B gồm 2 kim loại trên và hỗn hợp oxit của chúng. Đem hòa tan hết lượng hỗn hợp B bằng dung dịch H2SO4 đặc nóng dư thì thu được 0,3 mol SO2. Tính x?
Giải:
– Theo bài ra: x mol Fe, 0,15 mol Cu nên ta có: mFe = 56x; mCu = 0,15.64 = 9,6(g).
– Theo định luật bảo toàn e thì: 3nFe + 2nCu = 2nSO2 + 2nO
⇔ 3x + 2.0,15 = 2.0,3 + 2.nO ⇒ nO = 1,5x – 0,15 ⇒ mO = 16(1,5x-0,15) = 24x-2,4 (*)
– Theo định luật BTKL ta có: mO = mB – (mFe + mCu) = 63,2 – (56x + 0,15.64) (**)
– Từ (*) và (**) ⇒ 24x-2,4 = 63,2 – (56x + 0,15.64) ⇒ 80x = 56 ⇒ x = 0,7 (mol)
Câu 5: Hoà tan hoàn toàn 2,44g hỗn hợp bột X gồm FexOy và Cu bằng dung dịch H2SO4 đặc nóng (dư). Sau phản ứng thu được 0,504 lít khí SO2 (sản phẩm khử duy nhất đo ở ĐKTC) và dung dịch chứa 6,6 gam hỗn hợp muối sunfat. Tính % khối lượng của Cu trong X.
Giải:
– Theo bài ra thu được 0,504 lít khí SO2, ta có: nSO2 = 0,504/22,4 = 0,0225(mol).
– Gọi a, b, c là số mol của Fe, Cu và O trong hỗn hợp: 56a + 64b + 16c = 2,44 (*)
– Trong quá trình pư thì: Fe nhường 3e, Cu nhường 2e, S nhận 2e và O nhận 2e
– Theo định luật bảo toàn e ta có: 3nFe + 2nCu = 2nO + 2nSO2
⇔ 3a + 2b = 2c + 2nSO2 ⇔ 3a + 2b – 2c = 0,045 (**)
– nFe2(SO4)3 = (½).nFe = (½).a ; nCuSO4 = nCu = b(mol).
– Theo bài ra: mhh muối = mFe2(SO4)3 + mCuSO4 = 6,6(g).
⇒ 400.(½)a +160b = 6,6 ⇔ 200a +160b = 6,6 (***)
– Giải hệ gồm các pt (*), (**) và (***) ta có: a=0,025; b=0,01; c=0,025;
⇒ mCu = 64.0,01 = 0,64(g)
⇒ %mCu = (0,64/2,44).100% ≈ 26,23%
Sau khi đọc xong bài viết của chúng tôi bạn có thể biết được Fe + S để vận dụng vào làm các bài tập từ cơ bản đến nâng cao nhanh chóng nhé