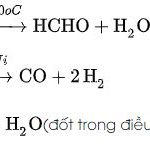Định nghĩa, tính chất hóa học và công thức tổng quát của Axit Cacbonic và muối cacbonat kèm VD
Axit Cacbonic và muối cacbonat là gì? Đây là những kiến thức bạn sẽ được học trong THPT. Nếu bạn chưa biết hay đã quên, thì cùng chúng tôi đi tìm hiểu cũng như ôn lại các kiến thức hóa học ngay trong bài viết dưới đây nhé!
Tham khảo thêm:
- Bảng Tính Tan Của Muối, muối nào tan trong nước và không tan
- Dãy Điện Hóa là gì ? Cách đọc Dãy Điện Hõa kim loại dễ thuộc
- Bảng hóa trị của các nguyên tố và cách học thuộc bằng bài ca hóa trị
Nội Dung
Axit cacbonic là gì?
Axit cacbonic là một hợp chất vô cơ được hình thành với số lượng nhỏ khi anhydrid, carbon dioxide (CO2), hòa tan trong nước. Ngoài ra, có thể coi axit cacbonic là một axit lưỡng cực mà từ đó hai loạt muối có thể được tạo thành, đó là hydro cacbonat, hoặc bicacbonat, chứa HCO3- và cacbonat, chứa CO32-.
H2CO3 + H 2O 3 H3O + + HCO3-
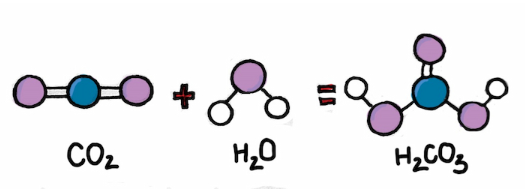
CO2 + H2O → H2CO3
H2CO3 ⇔ H+ + HCO3–
HCO3– ⇔ H+ + CO32-
Công thức hóa học của axit cacbonic là: H2C03
Khối lượng phân tử: 62,03 g/mol
Tính chất vật lý của aixit cacbonic
Trong nước tự nhiên và nước mưa có hòa tan khí cacbonic: 1000 m3 nước hòa tan được 90 m3 khí CO2.
Một phần khí CO2 tác dụng với nước tạo thành dung dịch axit cacbonic, phần lớn vẫn tồn tại ở dạng phân tử CO2
Tính chất hóa học của aixit cacbonic
– H2CO3 là một axit yếu: dung dịch H2CO3 chỉ làm quỳ tím chuyển thành màu đỏ nhạt, bị axit mạnh đẩy ra khỏi muối.
– H2CO3 là một axit không bền: H2CO3 tạo thành trong các phản ứng hóa học bị phân hủy ngay thành CO2 và H2O
Cách điều chế axit cacbonic.
Axit cacbonic là một axit rất yếu và nó gần như không tồn tại được lâu.
Người ta điều chế axit cacbonic bằng cách cho CO2 phản ứng với nước theo phương trình sau:
H2O + CO2 → H2CO3
Muối Cabonat là gì?
Muối cacbonat là muối của axit cacbonic, nó gồm 2 loại nhỏ là muối cacbonat CO32- và hidrocacbonat HCO3-.
Phân loại muối cacbonat
Có hai loại muối cacbonat:
– Muối cacbonat trung hòa (hay muối cacbonat), không còn nguyên tố H trong thành phần gốc axit.
Ví dụ: Na2CO3, CaCO3,..
– Muối cacbonat axit (hay muối hiđro cacbonat), có nguyên tố H trong thành phần gốc axit.
Ví dụ: NaHCO3, Ca(HCO3)2…
Tính tan của muối cacbonat
Muối cacbonat của các kim loại kiềm, amoni và đa số muối hiđrocacbonat đều tan. Muối cacbonat của kim loại khác thì không tan.
Tính chất hóa học muối cacbonat
Tính chất hóa học chung của muối:
Tác dụng với axit → muối mới + CO2 + H2O
NaHCO3 + HCl → NaCl + CO2↑ + H2O
+ H+ → CO2↑ + H2O
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
+ 2H+ → CO2↑ + H2O
Chú ý: Nếu cho H+ vào muối tan thì CO32- → HCO3– → H2O + CO2.
Nếu cho H+ vào muối không tan thì CO32- → CO2 + H2O.
+ Tác dụng với dung dịch kiềm → muối mới + bazơ mới
NaHCO3 + NaOH → Na2CO3 + H2O
+ Tác dụng với muối → 2 muối mới
Na2CO3 + CaCl2 → CaCO3 + 2NaCl
+ Tác dụng với kim loại đứng trước kim loại tạo muối → muối mới + kim loại mới
Cu(HCO3)2 + Mg → Mg(HCO3)2 + Cu
Phản ứng thủy phân: Muối cacbonat của kim loại kiềm bị thủy phân mạnh tạo môi trường kiềm:
Na2CO3 → 2Na+ + CO32-
CO32- + H2O ⇔ HCO3– + OH
→ Trong một số phản ứng trao đổi Na2CO3 đóng vai trò như 1 bazơ:
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3 + 6NaCl + 3CO2
Chú ý: Muối (NH4)2CO3 có môi trường trung tính.
Phản ứng nhiệt phân:
+ Muối cacbonat tan không bị nhiệt phân (trừ muối amoni), muối cacbonat không tan bị nhiệt phân:
MgCO3 → MgO + CO2 (tº)
+ Tất cả các muối hiđrocacbonat đều bị nhiệt phân:
2NaHCO3 → Na2CO3 + CO2 + H2O
Ca(HCO3)2 → CaCO3 + H2O + CO2
Cách nhân nhận biết muối cacbonat
Cho tác dụng với axit → CO2
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Ứng dụng của muối cacbonat
– CaCO3 là thành phần chính của đá vôi, được dùng để sản xuất vôi, xi măng…
– Na2CO3 được dùng để nấu xà phòng, sản xuất thủy tinh,..
– NaHCO3 được dùng làm dược phẩm, hóa chất trong bình cứu hỏa,…
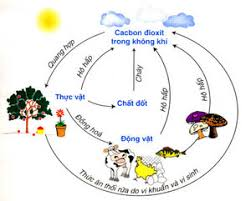
Chu trình tự nhiên của cacbonat
Trong tự nhiên luôn có sự chuyển hóa cacbon tự dạng này sang dạng khác. Sự chuyển hóa này diễn ra thường xuyên, liên tục và tạo thành chu trình khép kín.
Các dạng bài tập axit cacbonic và muối cacbonic thường gặp
Bài 1: Hãy lấy ví dụ chứng tỏ rằng H2CO3 là axit yếu hơn HCl và là axit không bền.
Lời giải:
Axit HCl tác dụng với muối cacbonat tạo thành axit cacbonic.
2HCl + Na2CO3 → 2NaCl + H2CO3
H2CO3 là axit không bền, bị phân hủy ngay cho CO2 và H2O nên phương trình được viết là:
2HCl + Na2CO3 → 2NaCl + CO2 ↑ + H2O.
Bài 2: Dựa vào tính chất hóa học của muối cacbonat, hãy nêu tính chất của muối MgCO3 và viết các phương trình hóa học minh họa.
Lời giải:
MgCO3 có tính chất của muối cacbonat.
– Tác dụng với dung dịch axit:
MgCO3 + H2SO4 → MgSO4 + CO2 ↑ + H2O.
– MgCO3 không tan trong nước, không tác dụng với dung dịch muối và dung dịch bazơ.
– Dễ bị phân hủy:
MgCO3 
Bài 3: Viết các phương trình hóa học biểu diễn chuyển hóa sau:
![]()
Lời giải:
Các phương trình hóa học:
(1) C + O2 → CO2
(2) CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
(3) CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Bài 4: Hãy cho biết trong các cặp chất sau đây, cặp nào có thể tác dụng với nhau.
a) H2SO4 và KHCO3
b) K2CO3 và NaCl
c) MgCO3 và HCl
d) CaCl2 và Na2CO3
e) Ba(OH)2 và K2CO3
Giải thích và viết các phương trình hóa học.
Giải:
Những cặp chất tác dụng với nhau:
a) H2SO4 + 2KHCO3 → K2SO4 + 2CO2 ↑ + 2H2O
c) MgCO3 + 2HCl → MgCl2 + CO2 ↑ + H2O
d) CaCl2 + Na2CO3 → CaCO3 ↓ + 2NaCl
e) Ba(OH)2 + K2CO3 → BaCO3 ↓ + 2KOH
Cặp chất không tác dụng với nhau: b).
Lưu ý: Điều kiện của phản ứng trao đổi trong dung dịch chỉ xảy ra nếu sản phẩm có chất kết tủa( không tan) hoặc có chất khí tạo thành.
Bài 5: Có 2 dung dịch K2SO4 và K2CO3 thuốc thử nào sau đây có thể nhận biết 2 dung dịch trên ?
Giải:
Sử dụng dung dịch HCl
+ Có khí thoát ra → K2CO3
K2CO3 + 2HCl → 2KCl + CO2 ↑ + H2O
+ Không hiện tượng là K2SO4.
Bài 6: Dãy gồm các chất đều phản ứng với dung dịch HCl ở điều kiện thường là
Giải:
Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O
CaCO3 + 2HCl → CaCl2 + CO2 ↑ + H2O
Mong rằng những nội dung trên đây sẽ giúp bạn trả lời được những thắc mắc câu hỏi của mình. Hơn hết đó là có thể giải được những bài toán của mình