Lý thuyếtH2+N2 → NH3 và bài tập có đáp án
H2+N2 → NH3 là phương trình phản ứng ở nhiệt độ cao và có mặt chất xúc tác, nito tác dụng trực tiếp với hidro tạo ra khí amoniac. Được áp dụng rất nhiều trong suốt quá trình học hóa học lớp 11 chính vì vậy, THPT Chuyên Lam Sơn sẽ phân tích phương trình phản ứng N2 ra NH3 chi tiết trong bài viết dưới đây để các bạn cùng tham khảo
Tham khảo thêm:
- 2FeCl2 + Cl2 → 2FeCl3: Lý thuyết và bài tập có đáp án
- S + H2SO4 → SO2 + H2O: Lý thuyết và bài tập có đáp án
- NO2 + O2 + H2O → HNO3: Lý thuyết và bài tập có đáp án
Nội Dung
Phương trình phản ứng N2 ra NH3:
![]()
Điều kiện phản ứng N2 tác dụng H2: Ở nhiệt độ cao, áp suất cao và có mặt chất xúc tác
Tính chất hóa học của Nito
Trong các hợp chất nitơ có các số oxi hóa: -3 ; +1 ; +2 ; +3 ; +4 ; +5. Các mức số oxi hóa tùy thuộc vào các nguyên tố khác trong hợp chất.
Do vậy Nitơ có tính oxi hóa và tính khử.
Tính oix hóa vẫn là tính chất chủ yếu của nitơ
Tính oxi hóa ( No + 3e → N-3)
+) Tác dụng với kim loại (Ca, Mg, Al,…) tạo thành nitrua kim loại.
Thí dụ:
Ca + N20 → Ca3N2-3
+) Tác dụng với hiđro tạo ra khí amoniac
Điều kiện: Nhiệt độ cao, áp suất cao và có mặt chất xúc tác
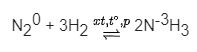
Nhận xét:Trong những phản ứng thí dụ trên số oxi hóa của nguyên tố nit ơ giảm từ 0 đến – 3 => Nitơ thể hiện tính oxi hóa
Tính khử:
- Nitơ tác dụng với oxi trong từng điều kiện khác nhau thì nguyên tử nitơ có số oxi hóa khác nhau.
- Khoảng 3000oC ( hoặc nhiệt độ lò hồ quang điện), ni ơ phản ứng trực tiếp với oxi tạo ra nitơ monooxit NO
![]()
Nhận xét: Ở thí dụ trên số oxi hóa oxi tăng từ 0 lên + 2 => Nitơ thể hiện tính khử
Điều kiện thường, khí NO không màu tác dụng ngay với oxi trong không khí tạo ra nitơ đioxit NO2 có màu nâu đỏ:
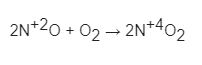
Bài tập phản ứng N2 ra NH3
Bài 1. Một hỗn hợp khí gồm N2 và H2 có tỉ khối đối với hidro là 3,6. Đun nóng hỗn hợp 1 thời gian rồi đưa về được ban đầu thì hồn hợp mới có tỉ khối với hidro là 4,5.
a. Tính thành phần % về thể tích của mõi khí trong hỗn hợp trước và sau phản ứng
b. Tính hiệu suất
Giải:
Áp dụng phương pháp đường chéo, ta có
28 52
36.2
2 20.8
nN2/nH2 = 1/4
Phương trình hóa học: N2 + 3H2 → 2NH3
Ban đầu: 1 4 0
Phản ứng x 3 x 2x
Sau 1- x 4-3x 2x
Ta có: m trước = msau => 7,2.nt = 8 ns
=> nt/ns = 10/9
=> x = 0,25
Vậy H% = x/1 = 0,25% (tính theo N2 vì tỉ lệ ban đầu so với hệ số tỉ lượng thì H2 dư nhiều hơn N2)
Câu 2. Dẫn 2,24 lít NH3 (đktc) đi qua ống đựng 32 gam CuO nung nóng thu được chất rắn A và khí B. Ngâm chất rắn A trong dung dịch HCl 2M dư. Tính thể tích dung dịch axit đã tham gia phản ứng ? Coi hiệu suất quá trình phản ứng là 100%
Giải;
nNH3= 0,1 mol, nCuO = 0,4 mol.
Phương trình phản ứng:
2NH3 + 3CuO → 3Cu + N2 + 3H2O (1)
mol: 0,1 0,4 → 0,15
=> nCuO dư = 0,4 – 0,15 = 0,25 mol
A gồm Cu (0,15 mol) và CuO dư (0,25 mol)
Phản ứng của A với dung dịch HCl :
CuO + 2HCl → CuCl2 + H2O (2)
mol: 0,25 → 0,5
Theo (2) và giả thiết ta suy ra:
VHCl = 0,5/2 = 0,25 lít.
Câu 3. Phần trăm khối lượng của N trong một oxit của nó là 30,43%.Tỉ khối của A so với He bằng 23. Xác định CTPT của oxit đó là:
Giải:
Phân tử khối của A là 46. Gọi công thức của oxit là NxOy
Có %N/%O = 14x/16y = 30,43/69,57
suy ra x/y = 1/2 → Công thức đơn giản nhất là NO2
Mà MA = 46→ A là NO2
Câu 4 :Phải dùng bao nhiêu lít khí nitơ và bao nhiêu lít khí hidro để điều chế 17 gam NH3 ? Biết rằng hiệu suất chuyển hóa thành amoniac là 25 %. Các thể tích khí đo được ở đktc .
Giải:
Lời giải chi tiết cụ thể :nNH3 = 17 : 17 = 1 mol
PTHH : N2 + 3H2→2NH3
0,5 ← 1,5 ← 1 ( mol )
Do hiệu suất phản ứng H = 25 % nên lượng cần dùng lớn hơn lượng đo lường và thống kê được :
nN2 cần dùng = 0,5. ( 100 / 25 ) = 2 mol => V N2 cần dùng = 44,8 lít
nH2 cần dùng = 1,5. ( 100 / 25 ) = 6 mol => V H2 cần dùng = 134,4 lít
Câu 5: Từ 34 tấn NH3 sản xuất 160 tấn HNO3 63%. Hiệu suất của phản ứng điều chế HNO3
Giải:
Phương trình hóa học
4NH3 + 5O2 → 4NO + 6H2O
2NO + O2 → 2NO2
4NO2 + 2H2O + O2→ 4HNO3
m(HNO3) = 160.63% = 100,8 (tấn)
n(NH3) = 34/17 = 2 mol
=> m(HNO3 thực tế) = 2.63 = 126 (tấn)
Vậy H = 100,8/126 = 80%.
Mong rằng những nội dung trên liên quan đến N2 ra NH3 sẽ giúp bạn trả lời được những thắc mắc câu hỏi của mình. Hơn hết đó là có thể giải được những bài toán của mình

