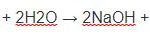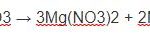Lý thuyết NH4NO3 → N2O + 2H2O và bài tập có đáp án
NH4NO3 → N2O + 2H2O là phương trình nhiệt phân NH4NO3 ở nhiệt độ < 500oC để tạo ra khí N2O. Với NH4NO3 nhiệt độ ở các mức nhiệt khác nhau thì sẽ thu được sản phẩm sau phản ứng khí khác nhau. Hy vọng tài liệu giúp ích cho các bạn học sinh trong quá trình học tập cũng như vận dụng làm bài tập. Mời các bạn tham khảo.
Tham khảo thêm:
Nội Dung
Phương trình nhiệt phân NH4NO3
NH4NO3 → N2O + 2H2O
Điều kiện nhiệt phân NH4NO3:
- Nung NH4NO3 ở nhiệt độ < 500oC tạo ra khí N2O
- Nếu nung NH4NO3 ở nhiệt độ > 500 độ C tạo ra khí N2
NH4NO3 → N2 + H2O
Kiến thức liên quan đến nhiệt phân muối amonitrat
Lý giải tại sao cùng là nhiệt phân nhưng lại cho ra các sản phẩm khác nhau.
Thì thực chất quá tình nhiệt phân ở từng mức nhiệt độ khác nhau sẽ cho sản phẩm khác nhau. Ở 210°C thì sẽ cho ra khí NO2 ( khí cười) và khí NH3.
Cụ thể
7NH4NO3 → 6NH3 + 8NO2 + 5H2O
Bài tập phản ứng của nhiệt phân NH4NO3
Câu 1. Cho dung dịch NaOH dư vào 100 ml dung dịch(NH4)2SO4 1M, đun nóng nhẹ. Tinh thể tích NH3 thu được ở đktc?
Giải:
n(NH4)2SO4 = 0,1 mol
(NH4)2SO4 + 2NaOH→ Na2SO4 + 2NH3 + 2H2O
0,1 → 0,2
=> VNH3 = 0,2 .22,4 = 4,48 lit
Câu 2. Nung 13,16 gam Cu(NO3)2trong bình kín không chứa không khí, sau một thời gian thu được 9,92 gam chất rắn và hỗn hợp khí A. Hấp thụ hoàn toàn A vào nước để được 600 ml dung dịch B. Dung dịch B có pH bằng
Giải:
nCu(NO3)2 ban đầu = 0,07 mol.
Gọi nCu(NO3)2phản ứng = x mol
Phương trình nhiệt phân
2Cu(NO3)2 → 2CuO + 4NO2+ O2
x → x → 2x → 0,5x
Khối lượng chất rắn giảm = khối lượng khí bay đi
=> mNO2 + mO2 = 2x.46 + 0,5x.32 = 13,16 – 9,92
=> x = 0,03 mol
Hấp thụ A vào nước :
4NO2 + O2 + 2H2O → 4HNO3
0,06 → 0,015 → 0,06
=> [ H+ ] = 0,06/0,6 = 0,1M
=> pH = 1
Câu 3: Cho dung dịch NaOH dư vào 150.0 ml dung dịch (NH4)2SO4 1,00M, đun nóng nhẹ.
a. Viết phương trình hoá học ở dạng phân tử và dạng ion rút gọn?
b. Tính thể tích khí (đktc) thu được?
Giải:
a) 2NaOH + (NH4)2SO4 → 2NH3↑ + Na2SO4 + 2H2O
NH4+ + OH- → 2NH3↑ + H2O
b) n(NH4)2SO4 = 0,15. 1 = 0,15 mol
Theo phương trình: nNH3 = 2. n(NH4)2SO4 = 0,15. 2 = 0,3 mol
VNH3 = 0,3. 22,4 = 6,72 lít
Câu 4: Trình bày phương pháp hoá học để phân biệt các dung dịch: NH3, Na2SO4, NH4Cl, (NH4)2SO4. Viết phương trình hoá học của các phản ứng đã dùng
Giải:
Cho quỳ tím vào từng ống: Ống màu xanh chứa dung dịch NH3, hai ống màu hồng là NH4Cl và (NH4)2SO4. Ống không có hiện tượng gì là Na2SO4.
Cho Ba(OH)2 vào hai ống làm hồng quỳ tím. Ống có khí bay ra mùi khai là NH4Cl, ống vừa có khí bay ra mùi khai vừa có kết tủa là (NH4)2SO4.
(NH4)2SO4 + Ba(OH)2 → BaSO4 ↓ + 2NH3 ↑ + 2H2O
2NH4Cl + Ba(OH)2 → BaCl2 + 2NH3 + 2H2O
Câu 5: Nhiệt phân hoàn toàn m gam NH4NO3 thu được 4,48l khí (đkc). Giá trị m là?
Giải:
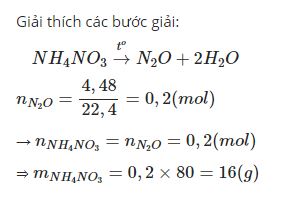
Sau khi đọc xong bài viết của chúng tôi bạn có thể biết được Nhiệt phân NH4NO3 để vận dụng vào làm các bài tập từ cơ bản đến nâng cao nhanh chóng nhé