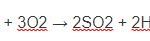Lý thuyết Zn + HCl → ZnCl2 + H2 và bài tập có đáp án
Zn + HCl → ZnCl2 + H2 được THPT Chuyên Lam Sơn biên soạn hướng dẫn các bạn học sinh viết trình điều chế khí hidro trong phòng thí nghiệm. Mời các bạn tham khảo chi tiết nội dung phương trình Zn tác dụng với HCl.
Tham khảo thêm:
- FeS2 + HNO3→ Fe(NO3)3 + H2SO4 + NO + H2O
- NaHCO3 + HCl → NaCl + CO2 + H2O
- Mg + HNO3 → Mg(NO3)2 + NH4NO3 + H2O
Nội Dung
Phương trình phản ứng Zn tác dụng HCl:
Zn + 2HCl → ZnCl2 + H2↑
Điều kiện để phản ứng Zn tác dụng HCl: Nhiệt độ
Điều chế H2 trong phòng thí nghiệm
+) Trong phòng thí nghiệm để điều chế H2 thường sử dụng axit HCl (hoặc H2SO4 loãng) và kim loại Zn (hoặc Fe, hoặc Al).
Zn + 2HCl → ZnCl2 + H2↑
+) Khí H2 ít tan trong nước và nhẹ hơn không khí nên ta có thể thu H2 theo 2 cách: Đẩy nước và đẩy không khí.
Tính chất hóa học của hidro
Hidro tác dụng với oxi
Phương trình hóa học:
2H2 + O2→ 2H2O
+) Lưu ý: rằng khi hỗn hợp khí oxi và khí hidro sẽ gây nổ. Nếu như chúng ta trộn hai khí này theo tỉ lệ 2:1 thể tích Khí hiđro và khí oxi thì hỗn hợp sẽ tạo nổ mạnh nhất.
+) Nguyên nhân tạo ra hiện tượng này bao nhiêu đó chính là hỗn hợp cháy rất nhanh và tỏa nhiều nhiệt.
+) Nhiệt này sẽ làm cho thể tích của hơi nước tạo nên sau khi phản ứng tăng cao đột ngột rất nhiều lần. Vì vậy sẽ làm chấn động mạnh đến không khí và gây nổ.
Hidro tác dụng với đồng oxit
+) Khi cho khí hidro đi qua bột đồng II thì oxit CuO sẽ chuyển thành màu đen.
+) Khi ống đựng bột CuO được đun nóng ở dưới ngọn lửa của đèn cồn. Sau đó sẽ cho khí H2 đi qua thì ta sẽ nhìn thấy có xuất hiện một chất rắn màu đỏ gạch và sẽ có nước đọng ở trên thành của ống nghiệm.
+) Hidro phản ứng với đồng oxit ở nhiệt độ khoảng 400°C
H2 + CuO → Cu+ H2O
+) Trong phản ứng hóa học trên, hidro đã chiếm chỗ của oxi trong CuO. Ta nói hidro có tính khử
Bài tập phản ứng Zn + HCl
Câu 1. Dung dịch A chứa 0,4 mol HCl, dung dịch B chứa 0,2 mol KHCO3 và 0,3 mol K2CO3. Nếu cho từ từ dung dịch A vào dung dịch B thì thoát ra x mol khí . Nếu cho từ từ dung dịch A vào dung dịch B thì thoát ra y mol khí. Giá trị của x và y lần lượt là
Giải:
Nếu cho từ từ HCl (X) vào dung dịch Y, phản ứng 1 và 2 sau đây sẽ xảy ra lần lượt:
HCl + K2CO3 → KHCO3 + KCl (1)
HCl + KHCO3 → KCl + H2O + CO2 (2)
Phản ứng 1: nK2CO3 = nHCl p/u (1) = 0,3 mol
Phản ứng 2: nCO2= nHCl p/u (2) = 0,4 – 0,3 = 0,1 mol
Nếu cho từ từ Y vào dung dịch HCl (X): phản ứng 3 và 4 sau đây sẽ xảy ra đồng thời:
2HCl + K2CO3 → KCl + H2O + CO2 (3)
HCl + KHCO3 → KCl + H2O + CO2 (4)
Tỉ lệ số mol phản ứng là: nKHCO3 : nK2CO3 = 2 : 3
Đặt số mol KHCO3 phản ứng là x thì số mol K2CO3 phản ứng là 1,5x
Phản ứng 3: nHCl p/u (3) = 2nCO2= 3x
Phản ứng 4: nHCl p/u (4) = nKHCO3 = x
Ta có: nHCl = 4x = 0,4 mol .
Vậy x = 0,1 mol
nCO2 = 1,5x + x. Vậy nCO2 = 0,25 mol
Câu 2: Dãy nào sau đây chỉ gồm các chất vừa tác dụng được với dung dịch HCl, vừa tác dụng được với dung dịch AgNO3 ?
Giải:
Cr + 2HCl → CrCl2 + H2
Fe + 2HCl → FeCl2 + H2
2Al + 6HCl → 2AlCl3 + 3H2
Cr + 2AgNO3 → Cr(NO3)2 + 2Ag
Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
Al + 3AgNO3 → Al(NO3)3 + 3Ag
Câu 3: Hòa tan hoàn toàn 15,4 gam hỗn hợp Mg và Zn trong dung dịch HCl dư thấy có 0,6 gam khí H2 bay ra. Khối lượng muối tạo thành trong dung dịch là
Giải:
nCl- = nHCl = 2nH2 = 0,6 mol.
Ta có: mmuối = mKL + 35,5. nCl-
⇒ mmuối = 36,7 gam.
Câu 4: Cho m gam hỗn hợp kim loại Zn, Cu vào dung dịch HCl (dư). Sau khi các phản ứng xảy ra hoàn toàn, thu được 4,48 lít H2 (đktc) và 2,0 gam kim loại không tan. Gía trị của m là:
Giải:
Cu không phản ứng với dung dịch HCl. 2 gam chất rắn không tan chính là khối lượng của Cu.
nZn = nH2 = 4,48/22,4 = 0,2 mol;
⇒ mZn = 65.0,2 = 13g;
⇒ m = 13 + 2 = 15g.
Câu 5. Kim loại tác dụng với dung dịch HCl và tác dụng với khí Cl2 đều thu được cùng một muối là
Giải:
Cu, Ag không phản ứng với HCl => Loại
Fe tác dụng Cl2 tạo FeCl3; Fe tác dụng HCl tạo FeCl2
Zn tác dụng với Cl2 và HCl đều tạo ZnCl2
Zn + Cl2 → ZnCl2
Zn + 2HCl → ZnCl2 + H2
Sau khi đọc xong bài viết của chúng tôi bạn có thể biết được Zn + HCl để vận dụng vào làm các bài tập từ cơ bản đến nâng cao nhanh chóng nhé