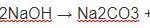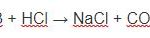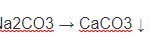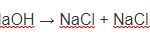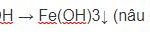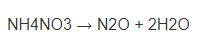Lý thuyết Na2CO3 + HCl → NaCl + CO2 + H2O và bài tập có đáp án
Na2CO3 + HCl → NaCl + CO2 + H2O là phương trình HCl tác dụng với Na2CO3 được THPT Chuyên Lam Sơn biên soạn gửi tới bạn đọc. Hy vọng với nội dung phương trình này giúp các bạn học sinh viết và cân bằng chính xác phản ứng Na2CO3 ra NaCl, từ đó vận dụng vào giải các dạng câu hỏi bài tập.
Tham khảo thêm:
Nội Dung
Phương trình Na2CO3 tác dụng HCl
Na2CO3 + 2HCl → 2NaCl + CO2+ H2O
Điều kiện phản ứng HCl tác dụng với Na2CO3: Nhiệt độ phòng
Cách thực hiện phản ứng Na2CO3 ra NaCl: Sục khí clo vào ống nghiệm chứa Na2CO3.
Hiện tượng nhận biết phản ứng Na2CO3 ra NaCl: Có khí không màu thoát ra.
Tính chất hóa học của Na2CO3
Na2CO3 là chất lưỡng tính tác dụng được cả axit và bazơ, Na2CO3 là muối trung hòa tạo môi trường trung tính nên nó có tác dụng đầy đủ tính chất hóa học như sau.
Tác dụng với axit mạnh tạo thành muối và nước giải phóng khí CO2
Na2CO3+ 2HCl → 2NaCl + H2O + CO2↑
Tác dụng với bazơ tạo muối mới và bazo mới
Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3↓
Tác dụng với muối tạo hai muối mới
Na2CO3 + BaCl2→ 2NaCl + BaCO3
+) Chuyển đổi qua lại với natri bicacbonat theo phản ứng:
Na2CO3 + CO2 + H2O ⇌ 2NaHCO3
+) Khi tan trong nước, Na2CO3 bị thủy phân:
Na2CO3 → 2Na+ + CO32−
CO32− + H2O ⇌ HCO3− + OH− ⇒ Dung dịch Na2CO3 có tính base yếu.
+) Na2CO3 bị thủy phân mạnh tạo môi trường bazơ, làm đổi màu các chất chỉ thị:
- Chuyển dung dịch phenolphtalein không màu sang màu hồng.
- Na2CO3 làm quỳ tím chuyển sang màu xanh.
Bài tập phản ứng Na2CO3 ra NaCl
Câu 1. Cho các chất sau: FeS, FeS2, FeO, Fe2O3, Fe(OH)2, FeCO3, FeSO3, Fe(OH)3, FeSO4. Có bao nhiêu chất khi cho tác dụng với H2SO4 đặc, nóng có khí SO2 thoát ra?
Giải:
Các chất khi cho tác dụng với H2SO4 đặc, nóng có khí SO2 thoát ra là: FeS, FeS2, FeO, Fe(OH)2, FeCO3, FeSO3, FeSO4
Phương trình phản ứng minh họa
2FeS + 10H2SO4 → Fe2(SO4)3+ 9SO2 + 10H2O
2FeS2 + 14H2SO4 → Fe2(SO4)3 + 15SO2 + 14H2O
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2↑ + 4H2O
8Fe(OH)2 + 13H2SO4 → 4Fe2(SO4)3 + H2S + 20H2O
2FeCO3 + 4H2SO4→ Fe2(SO4)3+ SO2 + 2CO2 + 4H2O4H2SO4 + 2 FeSO3 → Fe2(SO4)3 + 3 SO2 + 4 H2O
2FeSO4 + 2H2SO4 → Fe2(SO4)3 + SO2 + 2H2O
Các chất pư được với dung dịch KOH loãng nóng là: Al, CO2, FeCl2, KHCO3, CuSO4, MgCl2 → cả 6 chất
Phương trình hóa học minh họa
Al + KOH + H2O → KAlO2 + 3/2 H2O
CO2 + KOH → KHCO3 hoặc CO2 + 2KOH → K2CO3 + H2O
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
KHCO3 + KOH → K2CO3 + H2O
CuSO4 + 2KOH → Cu(OH)2↓ + K2SO4
MgCl2 + 2KOH → Mg(OH)2↓ + KCl
Câu 3. Nhỏ từ từ từng giọt đến hết 30 ml dung dịch HCl 1M vào 100 ml dung dịch chứa K2CO3 0,2M và KHCO3 0,2M, sau phản ứng thu được số mol CO2 là
Giải:
Nhỏ từ từ HCl vào dung dịch thứ tự phản ứng:
H+ + CO32- → HCO3– (1)
H+ + HCO3– → CO2 + H2O (2)
nH+ = 0,03 mol
nCO32- = 0,02 mol < nH+
nH+ (2) = nCO2= 0,03 – 0,02 = 0,01 mol
Câu 4. Hấp thụ hoàn toàn 0,784 lít CO2 (đktc) vào 500ml dung dịch NaOH 0,08 M thu được dung dịch X. Thêm 250 ml dung dich Y gồm BaCl2 0,08 M và Ba(OH)2 a mol/l vào dung dịch X thu được 1,97 gam kết tủa và dung dịch Z. Tính a?
Giải:
nCO2 = 0,035 mol; nNaOH = 0,04 mol
⇒ nNa2CO3 = 0,005 mol; nNaHCO3 = 0,03 mol
⇒ nBaCO3 = 0,01 mol < nBaCl2 = 0,02 mol ⇒ nCO32- = nBaCO3 = 0,01 mol
OH– + HCO3– → CO32-
nOH– = nCO32- = 0,01 mol ⇒ a = 0,005/0,125 = 0,04 mol
Câu 5. Hỗn hợp R gồm 2 kim loại X và Y thuộc phân nhóm chính nhóm II, ở 2 chu kỳ liên tiếp. Cho 3,52 gam R tan hoàn toàn trong dung dịch HCl dư thu được 2,688 lít khí H2 (đktc). Cô cạn dung dịch sau phản ứng, khối lượng muối khan thu được là
Giải:
Phương trình phản ứng: R + 2HCl → RCl2 + H2
Ta có nHCl = 2nH2 = 0,24 mol
mmuối = mkim loại+ mCl– = 3,52 + 0,24. 35,5 = 12,04 gam.
Sau khi đọc xong bài viết của chúng tôi bạn có thể biết được Na2CO3 ra NaCl để vận dụng vào làm các bài tập từ cơ bản đến nâng cao nhanh chóng nhé