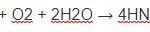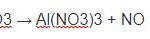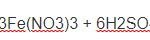Lý thuyết Fe + HNO3 → Fe(NO3)3 + NO+ H2O và bài tập có đáp án
Fe + HNO3 → Fe(NO3)3 + NO+ H2O là phản ứng oxi hóa khử. Sau đây THPT Chuyên Lam Sơn sẽ hướng dẫn các bạn cân bằng phản ứng oxi hóa khử lớp 10, cũng như tìm hiểu tính chất Hóa học của Al và tính chất hóa học HNO3…. cũng như các dạng bài tập.
Tham khảo thêm:
Nội Dung
Phương trình phản ứng Fe + HNO3 loãng:
Fe + 4HNO3 → Fe(NO3)3 + NO↑ + 2H2O
Cách cân bằng phương trình Fe + HNO3 → Fe(NO3)3 + NO + H2O:
Xác định số oxi hóa của các nguyên tố thay đổi
Fe0 + HN+5O3 → Fe+3(NO3)3+ N+2O + H2O
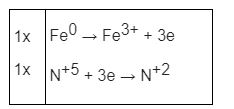
Vậy ta có phương trình: Fe + 4HNO3 → Fe(NO3)3 + NO↑ + 2H2O
Điều kiện phản ứng Fe tác dụng với HNO3 loãng: HNO3 loãng dư
Cách tiến hành phản ứng cho Fe tác dụng HNO3 loãng: Cho Fe (sắt) tác dụng với dung dịch axit nitric HNO3
Hiện tượng Hóa học: Kim loại tan dần tạo thành dung dịch muối Muối sắt(III) nitrat và khí không màu hóa nâu trong không khí NO thoát ra.
Tính chất hóa học cơ bản của sắt
Tác dụng với phi kim
Với oxi: 3Fe + 2O2 → Fe3O4
Với clo: 2Fe + 3Cl2 → 2FeCl3
Với lưu huỳnh: Fe + S → FeS
Ở nhiệt độ cao, sắt phản ứng được với nhiều phi kim.
Tác dụng với dung dịch axit
Tác dụng với với HCl, H2SO4 loãng
Fe + 2HCl → FeCl2 + H2
Tác dụng với H2SO4 đặc, nóng; HNO3 đặc:
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 4HNO3 → Fe(NO3)3 + NO↑ + 2H2O
Fe + 6HNO3 → Fe(NO3)3 + 3NO2 ↑ + 3H2O
Không tác dụng với H2SO4 đặc nguội, HNO3 đặc, nguội
Tác dụng với dung dịch muối
Đẩy được kim loại yếu hơn ra khỏi muối
Fe + CuSO4 → FeSO4 + Cu
Fe + AgNO3 → Fe(NO3)2 + Ag
Bài tập phản ứng Fe + HNO3
Câu 1. Nung nóng 25,2 gam Fe ngoài không khí sau một thời gian thu được m gam hỗn hợp X gồm Fe, FeO, Fe2O3 và Fe3O4. Hỗn hợp này phản ứng hết với dung dịch H2SO4 đặc nóng (dư), thu được 8,4 lít khí SO2 (sản phẩm khử duy nhất, ở đktc). Tính m?
Giải:
Ta có, nFe = 0,05 mol và nSO2 = 0.375 mol
Quy hỗn hỗn hợp X về 2 nguyên tố Fe và O
Quá trình nhường: Fe0 → Fe+3 + 3e
Quá trình nhận e: O0 + 2e → O-2
S+6 + 2e → S+4
Áp dụng định luật bảo toàn electron ta có:
1,35 = 2x + 0,75 → x = 0,3
Mặt khác ta có: nên: m = 25,2 + 0,3.16 = 30(gam).
Câu 2. Cho 22,72 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng (dư), thu được 2,688 lít khí NO (sản phẩm khử duy nhất, ở đktc) và dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Tính m?
Giải:
nNO= 2,688/22,4 = 0,12 mol
Coi hỗn hợp gồm Fe (x mol), O (y mol)
=> 56x + 16y = 22,72 (1)
Fe0 → Fe+3 + 3e
x → x → 3x
O0 + 2e → O-2
y → 2y
N+5 + 3e → N+2
0,36→ 0,12
Bảo toàn e => 3x = 2y + 0,36 (2)
(1),(2) => x = 0,32; y = 0,3
=> nFe(NO3)3 = nFe= 0,32mol
=> m = 0,32.242 = 77,44 gam
Câu 3. Hòa tan Fe3O4 vào dung dịch H2SO4 loãng dư thu được dung dịch X. Tìm phát biểu sai
A. Dung dịch X làm mất màu thuốc tím
B. Cho NaOH dư vào dung dịch X thu được kết tủa để lâu ngoài không khí kết tủa có khối lượng tăng lên.
C. Dung dịch X tác dụng được với Zn
D. Dung dịch X không thể hòa tan Cu
Phương trình phản ứng hóa học xảy ra
Fe3O4 + 4H2SO4→ FeSO4 + Fe2(SO4)3 + 4H2O
A đúng: FeSO4 làm mất màu thuốc tím trong H2SO4 loãng
B. FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4
C. FeSO4 + Zn → ZnSO4 + Fe
D sai: Cu + Fe2(SO4)3 → 2FeSO4 + CuSO4
Câu 4. Có 4 kim loại để riêng biệt: Ag, Al, Mg, Fe. Chỉ dùng hai thuốc thử có thể phân biệt được từng chất
Giải:
Dùng dung dịch HCl thì nhận ra được :
Kim loại Ag vì không có phản ứng
+ 3 kim loại còn lại đều tạo khí
Phương trình hóa học xảy ra
Mg + 2HCl → MgCl2 + H2↑
2Al + 6HCl → 2AlCl3 + 3H2↑
Fe + 2HCl → FeCl2 + H2↑
Dùng vài giọt dung dịch NaOH thì nhận ra được
+ Dung dịch MgCl2( có chứa kim loại ban đầu là Mg ) với hiện tượng có kết tủa trắng xuất hiện
Phương trình hóa học:
MgCl2 + 2NaOH → Mg(OH)2↓+ 2NaCl
+ Dung dịch AlCl3 ( có chứa kim loại ban đầu là Al ) với hiện tượng có kết tủa keo trắng sau đó tan dần
Phương trình hóa học:
AlCl3 + 4NaOH → NaAlO2 + 3 NaCl + 2H2O (PTHH viết gộp )
+ Dung dịch FeCl3 ( có chứa kim loại ban đầu là Fe) với hiện tượng có kết tủa màu trắng xanh xuất hiện , sau đó chuyển sang màu nâu khi để lâu ngoài không khí
Phương trình hóa học: FeCl2 + 2NaOH → Fe(OH)2↓+ 2NaCl
Câu 5. Cho m gam bột Fe vào 800 ml dung dịch hỗn hợp gồm Cu(NO3)2 0,2M và H2SO4 0,25M. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,6m gam hỗn hợp bột kim loại và V lít khí NO (sản phẩm khử duy nhất của N+5, ở đktc). Giá trị của m và V lần lượt là:
Giải:
Do sau phản ứng thu được hỗn hợp bột KL nên Fe dư, phản ứng tạo muối Fe2+
nCu2+ = nCu(NO3)2 = 0,16mol;
nNO3– = 2nCu(NO3)2 = 0,32 mol;
nH+ = 2nH2SO4 = 0,4 mol
Phương trình hóa học
3Fe + 8H+ + 2NO3– → 3Fe2+ + 2NO + 4H2O (Ta thấy: 0,4/8 < 0,32/2 nên H+ hết, NO3– dư)
0,15 ← 0,4 → 0,1 → 0,1
Fe + Cu2+ → Fe2+ + Cu
0,16 ← 0,16 → 0,16
Vậy nFe pư = 0,15 + 0,16 = 0,31 mol
=> mKL sau = mFe dư + mCu => m – 0,31.56 + 0,16.64 = 0,6m => m = 17,8 gam
=> VNO = 0,1.22,4 = 2,24 lít
Trong bài viết này, chúng tôi chưa đủ dữ liệu để nói về phản ứng Fe + HNO3 loãng nên chúng tôi luôn ghi nhận đóng góp thông tin từ quý đọc giả.