Cấu tạo vỏ nguyên tử là gì? Lý thuyết và các dạng bài tập có lời giải chi tiết từ A – Z
Cấu tạo vỏ nguyên tử là một trong những kiến thức quan trọng trong chương trình Hóa học lớp 10. Để tổng hợp lý thuyết, bài tập cũng như những kiến thức cơ bản về cấu tạo vỏ nguyên tử lớp 10, hãy cùng chúng tôi theo dõi bài giảng sau.
Tham khảo thêm:
- Công thức tính nồng độ phần trăm và các dạng bài tập có lời giải chi tiết nhất
- Lý thuyết về sự điện li của nước, pH, Chất chỉ thị Axit – bazơ và bài tập có lời giải từ A – Z
- Oxit là gì? Tính chất hóa học của Oxit, công thức hóa học của Oxit và bài tập minh họa
Nội Dung
Định nghĩa nguyên tử là gì?
Nguyên tử là những hạt có kích thước vô cùng nhỏ. Những hạt này trung hoà về điện và có khả năng tạo nên các chất và các nguyên tố hoá học.
Cấu tạo nguyên tử
Nguyên tử cấu tạo từ vỏ nguyên tử và hạt nhân.
- Cấu tạo vỏ nguyên tử bao gồm những electron mang điện tích âm.
- Hạt nhân bao gồm những hạt proton và notron. Hạt nhân nằm giữa nguyên tử và có điện tích dương.
- Số electron có trong vỏ nguyên tử = số proton có trong hạt nhân = Z

Sự chuyển động của electron trong nguyên tử
Trong nguyên tử, các electron chuyển động rất nhanh xung quanh hạt nhân không theo quỹ đạo xác định nào và tạo thành đám mây electron.
Obitan nguyên tử (AO)
Obitan nguyên tử là khu vực đám mây electron xung quanh hạt nhân mà xác suất có mặt electron khoảng 90%.
Hình dạng obitan nguyên tử: Dựa trên sự khác nhau về trạng thái electron trong nguyên tử ta có:
- Obitan s: dạng hình cầu.
- Obitan p: gồm 3 obitan px, py, pz có hình dạng số 8 nổi, định hướng theo 3 trục Ox, Oy, Oz của hệ tọa độ.
Lớp electron và Phân lớp electron
Lớp electron:
+) Lớp electron gồm các electron có mức năng lượng gần bằng nhau. Các lớp electron xếp theo thứ tự mức năng lượng từ thấp đến cao (từ gần nhân ra ngoài):
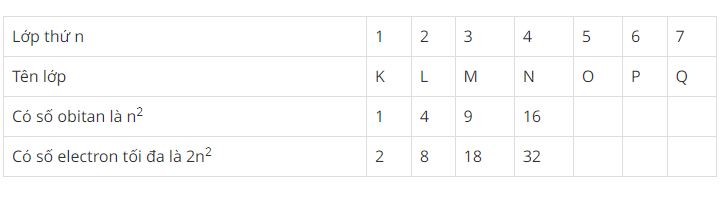
Phân lớp electron
+) Mỗi lớp electron chia thành các phân lớp s, p, d, f gồm các electron có mức năng lượng bằng nhau:
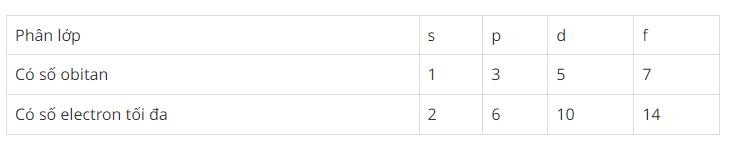
+) Trong 1 lớp electron thì số phân lớp = số thứ tự lớp:
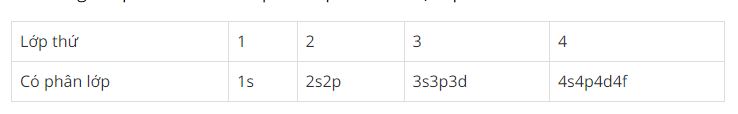
+)Phân lớp electron chứa electron tối đa gọi là phân lớp electron bão hòa.
Các dạng bài tập cấu tạo vỏ nguyên tử thường gặp
Câu 1: Tổng số các hạt proton, nơtron và electron trong nguyên tử của một nguyên tố là 40. Biết số hạt nơtron lớn hơn số hạt proton là 1. Cho biết nguyên tố trên thuộc loại nguyên tố nào?
Giải:
Giả sử số hiệu nguyên tử, số nơtron của nguyên tố trên lần lượt là Z, N
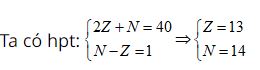
Cấu hình electron của nguyên tố là: 1s22s22p63s23p1
Nhận thấy electron cuối cùng điền vào phân lớp p → nguyên tố trên thuộc loại nguyên tố p.
Câu 2: X không phải là khí hiếm, nguyên tử nguyên tố X có phân lớp electron ngoài cùng là 3p. Nguyên tử nguyên tố Y có phân lớp electron ngoài cùng là 3s. Tổng số electron ở hai phân lớp ngoài cùng của X và Y là 7. Xác định số hiệu nguyên tử của X và Y
Giải:
TH1: Y có phân lớp ngoài cùng là 3s1 → Y có cấu hình electron là 1s22s22p63s1
→ Y có 11e → Y có Z = 11.
X có số electron ở phân lớp ngoài cùng = 7 – 1 = 6 → X có phân lớp ngoài cùng là 3p6 → X là khí hiếm → loại.
TH2: Y có phân lớp ngoài cùng là 3s2 → tương tự ta có Y có Z = 12.
Khi đó, X có lớp ngoài cùng là 3p5 → X có cấu hình electron là 1s22s22p63s23p5
→ X có 17 e → Z = 17.
Câu 3: Nguyên tử của nguyên tố T có e ở mức năng lượng cao nhất ở lớp e thứ 3, trong nguyên tử của Y số e nằm ở phân lớp s bằng 2/3 số e nằm ở phân lớp p. Nguyên tố T là
Giải:
Nguyên tử của nguyên tố T có e ở mức năng lượng cao nhất ở lớp e thứ 3 → số electron ở phân lớp s gồm 1s2, 2s2, 3s2 → 6 electron ở phân lớp s
→ Số electron ở phân lớp p là 9
Cấu hình của Y là 1s22s22p63s23p3 (Z = 15) → T là P
Câu 4: Nguyên tố X thuộc loại nguyên tố d, nguyên tử X có 5 electron hoá trị và lớp electron ngoài cùng thuộc lớp N.Cấu hình electron của X là:
Giải:
Nguyên tố X có electron lớp ngoài cùng thuộc lớp N → X có 4 lớp
Nguyên tố X thuộc loại nguyên tố d, nguyên tử X có 5 electron hoá trị → tổng số e phân lớp sát ngoài cùng và lớp ngoài cùng là 5
Cấu hình của X là 1s22s22p63s23p63d34s2
Câu 5: Nguyên tử M có cấu hình electron ngoài cùng là 3d74s2. Số hiệu nguyên tử của M
Giải:
Cấu hình electron của nguyên tử M là 1s22s22p63s23p63d74s2
Số hiệu nguyên tử của M là 27
Câu 6: Hợp chất H có công thức MX2 trong đó M chiếm 140/3% về khối lượng, X là phi kim ở chu kỳ 3, trong hạt nhân của M có số proton ít hơn số nơtron là 4; trong hạt nhân của X có số proton bằng số nơtron. Tổng số proton trong 1 phân tử A là 58. Cấu hình electron ngoài cùng của M là.
Giải:
Tổng số proton trong MX2 là 58 hạt → ZM + 2.ZX = 58
Trong hạt nhân M có số notron nhiều hơn số hạt proton là 4 hạt → -ZM + NM = 4
Trong hạt nhân X, số notron bằng số proton → ZX = NX
MA = ZM + NM + 2.ZX + 2.NX = (ZM + 2.ZX ) + NM + 2NX= 58 + NM + 58 – ZM = 116 + NM– ZM
M chiếm 46,67% về khối lượng → ZM + NM = 7.(116 + NM – ZM)/15 → 22ZM + 8NM = 812
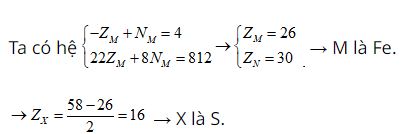
Cấu hình electron của M là [Ar]3d64s2.
Câu 7: A và B là hai nguyên tố đều có cùng số electron ở lớp ngoài cùng và là nguyên tố s hoặc p. biết rằng tổng số proton trong A và B là 32, A có ít hơn B một lớp electron. Số electron lớp ngoài cùng của A và B là
Giải:
Nếu A và B cùng là nguyên tố s hoặc p.
Nếu A ít hơn B 1 lớp electron thì A có thể ít hơn B là 2 hoặc 8 hoặc 18 electron.
Nếu eB – eA = 2 và eB + eA = 32.
⇒ eB = 17 và eA = 15 ( loại vì 2 nguyên tố này có cùng lớp electron).
Nếu eB – eA = 8 và eB + eA = 32 ⇒ eB = 20 và eA = 12 (chọn).
Nếu eB – eA = 18 và eB + eA = 32 ⇒ eB = 25 và eA = 7(loại vì 2 nguyên tố này khác nhau 2 lớp electron).
Vậy A và B có 2 electron ở lớp ngoài cùng.
Câu 8: Một nguyên tố thuộc khối các nguyên tố s haowcj p có 4 lớp electron, biết rằng lớp ngoài cùng có 4 electron. Nguyên tố này là
Giải:
Nếu lớp ngoài cùng có 4e ⇒ Cấu hình electron lớp ngoài cùng là 4s24p2 .
⇒ Cấu hình electron nguyên tử của nguyên tố này là: 1s22s22p63s23p63d104s24p2 .
Nguyên tố 32Ge .
Mong rằng những nội dung trên đây sẽ giúp bạn trả lời được những thắc mắc câu hỏi của mình. Hơn hết đó là có thể giải được những bài toán của mình
