Lý thuyết MnO2 + HCl → MnCl2+ Cl2 + H2O và bài tập có đáp án
MnO2 + HCl → MnCl2+ Cl2 + H2O là phương trình điều chế Clo trong phòng thí nghiệm bằng cách đun nóng nhẹ dung dịch axit HCl đậm đặc với chất có khả năng oxy hóa mạnh như mangan đioxit. Cho nên, TPHT Chuyên Lam Sơn sẽ giải thích phản ứng MnO2 tác dụng HCl kèm theo các ví dụ có lời giải để các bạn cùng tham khảo nhé
Tham khảo thêm:
Nội Dung
Phương trình phản ứng MNO2 + HCl:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
Điều kiện để phản ứng MnO2 ra Cl2: Nhiệt độ
Cách thực hiện phản ứng MnO2 ra Cl2: Cho MnO2 tác dụng với dung dịch HCl.
Hiện tượng nhận biết MnO2 ra Cl2: Chất rắn màu đen Mangan oxit (MnO2) tan dần và xuất hiện khí màu vàng lục Clo (Cl2) làm sủi bọt khí. Đồng thời có khí mùi sốc thoát ra.
Tính chất vật lý của Clo
Clo là chất khí, màu vàng, mùi xốc, độc và nặng hơn không khí.
Cl2 có một liên kết cộng hóa trị, dễ dàng tham gia phản ứng,là một chất oxi hóa mạnh.
Tham gia các phản ứng Clo là chất oxi hoá, tuy nhiên clo cũng có khả năng đóng vai trò là chất khử.
Tính chất hoá học của Clo
Tác dụng với kim loại
+) Đa số kim loại và có to để khơi màu phản ứng tạo muối clorua (có hoá trị cao nhất )
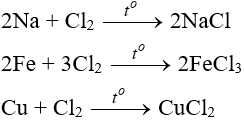
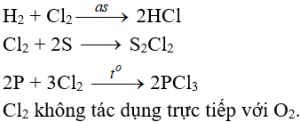
Tác dụng với phim kim
+) Cần có nhiệt độ hoặc có ánh sáng
Tác dụng với nước và dung dịch kiềm
+) Cl2 tham gia phản ứng với vai trò vừa là chất ôxi hóa, vừa là chất khử.
-Tác dụng với nuớc
Khi hoà tan vào nước, một phần Clo tác dụng (Thuận nghịch)
Cl20 + H2O → HCl + HClO (Axit hipoclorơ)
Axit hipoclorơ có tính oxy hoá mạnh, nó phá hửy các màu vì thế nước clo hay clo ẩm có tính tẩy màu do.
-Tác dụng với dung dịch bazơ
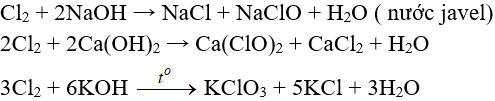
Tác dụng với muối của các halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3
Cl2 + 2KI → 2KCl + I2
Tác dụng với chất khử khác
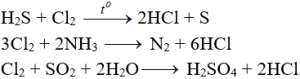
Phản ứng thế, phản ứng cộng, phản ứng phân huỷ với một số hợp chất hữu cơ
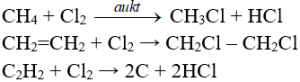
Điều chế Clo trong phòng thí nghiệm bằng cách nào?
+) Để điều chế Clo trong phòng thí nghiệm, người ta cho axit clohydric đặc tác dụng với một chất oxi hóa mạnh, có thể là mangan dioxit rắn hoặc kali penmanganat rắn,…Nếu dùng mangan dioxit thì cần xúc tác nhiệt độ còn với kali penmanganat thì có thể đun hoặc không đun nóng.
+) Vì khí clo thu được sau phản ứng thường bị lẫn tạp chất là khí hiđro clorua và hơi nước nên để điều chế khí nguyên chất, người thực hiện sẽ dẫn khí qua các bình rửa khí có chứa dung dịch NaCl để giữ lại HCl và chứa H2SO4 đặc để giữ hơi nước.
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 6H2O
+) Còn trong công nghiệp, khí Clo được điều chế bằng cách điện phân nóng chảy muối Natri clorua.
2NaCl → 2Na + Cl2
+) Hoặc điện phân dung dịch muối có màng ngăn, theo phương trình phản ứng như sau:
2NaCl + 2H2O → H2+ 2NaOH + Cl2
Bài tập phản ứng MNO2 + HCl
Câu 1. Hỗn hợp khí X gồm O2, Cl2, CO2, SO2. Để thu được O2 tinh khiết, người ta dẫn X qua:
Giải:
Để thu được O2 tinh khiết, người ta dẫn X qua dung dịch KOH vì Cl2, CO2và SO2đều có phản ứng
2KOH + Cl2→ KCl + KClO + H2O
CO2 + 2KOH → K2CO3 + H2O
SO2 + 2KOH → K2SO3 + H2O
Câu 2. Cho 29,2 gam HCl tác dụng hết với KMnO4, thu được V lít khí Cl2 (đktc). Giá trị của V là
Giải:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
⇒ nHCl = 29,2/36,5 = 0,8 (mol) ⇒ nCl2 = 0,8.5/16 = 0,25
V = 0,25 . 22,4 = 5,6 (l)
Câu 3. Cho 3,16 gam KMnO4 tác dụng với dung dịch HCl (dư), sau khi phản ứng xảy ra hoàn toàn thì số mol HCl bị oxi hoá là
Giải:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 8H2O + 5Cl2
Ta có nKMnO4 = 0,02
HCl có 2 phần, 1 là tạo môi trường, 2 là bị oxi hóa,
Mn7+ + 5e → Mn2+
2Cl- → Cl2 + 2e
bảo toàn e, ta có: nCl- khử = 5nMn7+ = 5. 0,02 = 0,1 mol
=> Số mol HCl bị oxi hóa là 0,1 mol
Tổng số mol HCl tham gia phản ứng là 0,16 mol
Câu 4. Thực hiện các thí nghiệm sau:
(a) Sục khí Cl2 vào dung dịch NaOH.
(b) Cho S tác dụng với H2SO4 đặc nóng
(c) Cho SO2 vào dung dịch KMnO4
(d) Cho SiO2 vào dung dịch HF.
Trong các thí nghiệm trên, số thí nghiệm có phản ứng oxi hóa – khử xảy ra là
Giải:
(a) Đúng
Cl2 + 2NaOH → NaCl + NaClO + H2O
(b) Đúng
(c) Đúng
5SO2 + 2KMnO4 + 2H2O → 2MnSO4+ K2SO4 + 2H2SO4
(d) Sai
SiO2 + 4HF → SiF4 + 2H2O
Câu 5. Điều chế Clo từ HCl và MnO2. Cho toàn bộ khí Cl2 điều chế được qua dung dịch NaI, sau phản ứng thấy có 25,4 gam I2 sinh ra. Khối lượng HCl đã dùng là:
Giải:
nI2= 25,4/254 = 0,1 mol
Theo phương trình hóa học:
Cl2 + 2NaI → 2NaCl + I2
=> nCl2 = nI2= 0,1 mol
Theo phương trình hóa học
MnO2 + 4HCl → MnCl2 + 2H2O + Cl2
=> nHCl = nCl2. 4 = 0,1.4 = 0,4 mol
=> mHCl = 0,4. 36,5 = 14,6 g
Sau khi đọc xong bài viết của chúng tôi bạn có thể biết được MNO2 + HCl để vận dụng vào làm các bài tập từ cơ bản đến nâng cao nhanh chóng nhé